
分析 (1)有磁性的固体Y为四氧化三铁,与盐酸反应生成氯化铁、氯化亚铁;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,加入到过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+;
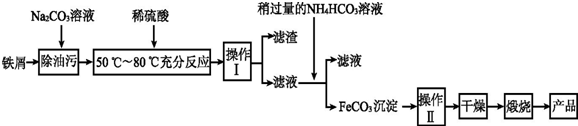
(3)由流程可知,碳酸钠水解显碱性,可除去油污,然后Fe与硫酸反应生成硫酸亚铁和氢气,操作I为过滤,滤液中亚铁离子与碳酸氢铵反应生成FeCO3,操作II为洗涤,干燥后煅烧FeCO3得到Fe2O3;
(4)①一定物质的量浓度溶液的配制结合配制步骤可得到每一步中使用的仪器,很明显缺少250 mL容量瓶;
②酸性高锰酸钾溶液呈紫红色,随着反应溶液颜色会发生改变,故不需要指示剂,可以利用高锰酸钾颜色变化指示滴定终点;
③结合反应的化学方程式可得亚铁离子和高锰酸根物质的量之比为5:1,以此计算.
解答 解:(1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,溶液中大量存在的阳离子是Fe2+、Fe3+、H+,故答案为:Fe3+、Fe2+、H+;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,加入到过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,
故答案为:BC;
(3)由流程可知,碳酸钠水解显碱性,可除去油污,然后Fe与硫酸反应生成硫酸亚铁和氢气,操作I为过滤,滤液中亚铁离子与碳酸氢铵反应生成FeCO3,操作II为洗涤,干燥后煅烧FeCO3得到Fe2O3;
①由上述分析可知,操作I、II分别为过滤、洗涤,故答案为:过滤;洗涤;
②在空气中煅烧FeCO3的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)①一定物质的量浓度溶液的配制结合配制步骤可得到每一步中使用的仪器,很明显缺少250 mL容量瓶,故答案为:250 mL容量瓶;
②酸性高锰酸钾溶液呈紫红色,随着反应溶液颜色会发生改变,故不需要指示剂,可以利用高锰酸钾颜色变化指示滴定终点,故答案为:不需要,可以利用高锰酸钾颜色变化指示滴定终点;
③结合反应的化学方程式可得亚铁离子和高锰酸根物质的量之比为5:1,则七水硫酸亚铁的质量分数为$\frac{0.01mol/L×0.2L×5×278g/mol×\frac{250}{25}}{2.85g}$×100%=97.5%,
故答案为:97.5%.
点评 本题考查物质制备实验及含量测定计算,为高频考点,把握制备实验流程、物质的性质、反应中的物质的量关系为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA | |
| B. | 将标准状况下,11.2LN2和33.6LH2混合,在一定条件下充分反应,产生的NH3的分子数为2NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1L 0.1mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
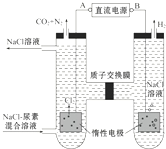
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是天然气的主要成分 | B. | 不能使稀的酸性高锰酸钾溶液褪色 | ||
| C. | 是一种植物生长调节剂 | D. | 是聚乙烯塑料袋的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
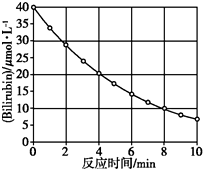 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
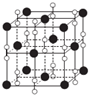 (1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:
(1)已知KCl、MgO、CaO、TiN这四种晶体的结构与NaCl晶体结构相似.下表给出了三种晶体的晶格能数据:| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
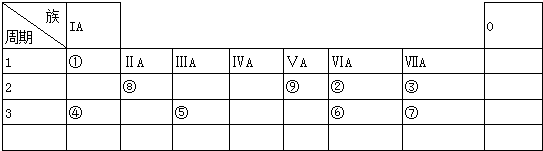

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学校研究性学习小组开展课题探究:
某学校研究性学习小组开展课题探究:| 组别 | 草酸的体积(mL) | 温度/℃ | 其他物质 |
| ?① | 2mL | 20 | |
| ?② | 2mL | 20 | 10滴饱和MnSO4溶液 |
| ?③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com