
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | ⑦ | ⑧ | | |
| 3 | ① | ③ | ④ | ⑥ | | ⑨ | ⑩ | |
| 4 | ② | | | | | | | |
 ;Cl2 + H2O = H+ + Cl- + HClO (2)KOH;Na+ >Mg2+>Al3+
;Cl2 + H2O = H+ + Cl- + HClO (2)KOH;Na+ >Mg2+>Al3+ ;氯气与水反应的离子方程式是Cl2 + H2O = H+ + Cl- + HClO。
;氯气与水反应的离子方程式是Cl2 + H2O = H+ + Cl- + HClO。

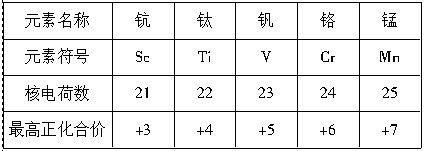
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.n=m+11 | B.n=m+25 | C.n=m+10 | D.n=m+1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.WZ2分子中所有原子最外层都为8电子结构 |
| B.WX2、ZX2的化学键类型相同 |
| C.WX2是以极性键结合成的直线型分子 |
| D.原子半径大小顺序是W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| B.热稳定性:HCl>HBr>HI |
| C.原子序数:Cl>S>P |
| D.原子半径:F>O>N |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com