
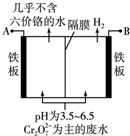
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )| A、A接电源负极 |
| B、阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2mol Cr2O72-被还原 |
| V |
| Vm |
| 13.44L |
| 22.4L/mol |
| 0.6mol×2 |
| 2 |
| 1 |
| 6 |


科目:高中化学 来源: 题型:
| A、一个氮氮叁键形成的同时,有3个H-H键形成 |
| B、一个氮氮叁键断裂的同时,有3个H-H键断裂 |
| C、一个氮氮叁键断裂的同时,有6个N-H键断裂 |
| D、一个氮氮叁键断裂的同时,有6个N-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:3 |
| C、3:2 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,4.6gNO2和N2O4混合物中含有的原子数为0.3NA |
| B、1mo1?L-1的A1C13溶液中,C1-离子的数目为3NA |
| C、标准状况下,22.4LCl2与足量NaOH溶液反应转移的电子数为2NA |
| D、标准状况下,22.4L SO3所含的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、16g CH4与18 g NH
| ||
| B、7.8gNa2O2与足量的CO2反应时转移的电子数为0.1NA | ||
| C、1 mol Cl2参加反应转移电子数一定为2 NA | ||
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质发生化学变化都伴随着能量变化 |
| B、任何反应中的能量变化都表现为热量变化 |
| C、同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件不同 |
| D、Ba(OH)2?8H2O与NH4Cl 的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |
| Y | Z |
| A、X的气态氢化物热稳定性强于Z的气态氢化物 |
| B、原子半径:X<Y<Z |
| C、若Y的最高正价为+m,则X,Z的最高正价一定为+(m+1) |
| D、Y和Z的最高价氧化物对应水化物酸性Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
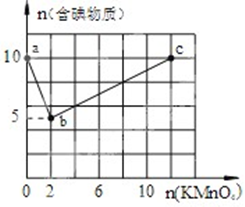 实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.
实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com