
【题目】下列说法中正确的是 ( )
A. 煤属于有机化合物
B. 在物质变化类型上,煤的干馏过程包含了物理变化和化学变化
C. 煤中含有大量的苯等芳香烃,煤是芳香烃的主要来源
D. 水煤气是通过煤的液化得到的气体燃料
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用.它们对应的钠盐同样也是重要的化工产品.
(1)(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解.工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
①烧瓶A中发生反应的离子方程式为: . 装置D的作用是 .
②装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水 b.饱和Na2SO3溶液c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 .
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
④为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是 .
(2)(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.Na2S2O5溶于水即生成NaHSO3 . ①证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测
②葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL ![]() 馏分
馏分 ![]() 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色
方程式为SO2+I2+2H2O=H2SO4+2HI)按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为gL﹣1 . 上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”).其原因是(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
(1)Ni2+基态核外电子排布式为 .
(2)ClO4﹣的空间构型是;与ClO4﹣互为等电子体的一种分子为(填化学式).
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2 , 碳酰肼中碳原子的杂化轨道类型为;1molCO(N2H3)2分子中含有σ键数目为 .
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成.NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a:b:c= . 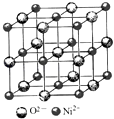
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法错误的是
A.喝下汽水后常会打嗝,说明气体的溶解度随温度升高而减小
B.自行车钢架生锈主要是电化学腐蚀所致
C.可以通过灼烧的方法鉴别锦纶和蚕丝
D.凡是有食品添加剂的食物对人体健康均有害,不可食用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室效应引起国际的关注,我国也积极应对,采取措施。中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是( )
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料的使用也会产生白色污染
D.聚二氧化碳塑料与干冰都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得。

下列有关说法不正确的是( )
A. 上述反应的原子利用率可达到100%
B. 在对羟基扁桃酸中有6种不同化学环境的氢原子
C. 对羟基扁桃酸可以发生加成反应、取代反应和缩聚反应
D. lmol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.淀粉、纤维素、油脂都是高分子化合物
B.石油分馏和煤的干馏过程,都属于物理变化
C.甲烷、汽油、柴油、酒精都是碳氢化合物,都可作燃料
D.聚乙烯是无毒高分子材料,可用于制作食品包装袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: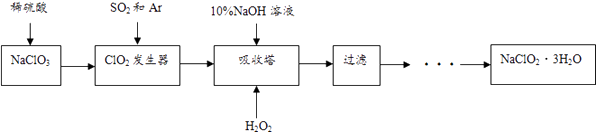
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O
②纯ClO2常温下为气体,易分解爆炸,一般用稀有气体或空气稀释到10%以下安全
(1)10%的NaOH溶液的密度为1.2g/cm3其物质的量浓度为 .
(2)在ClO2发生器中当1gSO2完全转化时,放出akJ热量,写出该热化学反应方程式鼓入Ar的作用是 .
(3)写出吸收塔内发生的化学反应方程式 . 吸收塔的温度不能超过40℃,其目的是 .
(4)从滤液中得到的NaClO23H2O粗晶体中往往含有杂质,要得到更纯的NaClO23H2O晶体方法是 .
(5)工业处理含NaClO2废水时,先向废水中加入适量NaOH,用惰性电极电解该废水,同时制得NaClO3 , 写出ClO2﹣在阳极放电时的电极反应方程式 .
(6)已知SO2和Ar的混合气体中,SO2的百分含量为5.6a%,当bL(标况下)该混合气体参加反应时,理论上需要的17%的H2O2的质量为g(结果必须化简).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com