
分析 (1)物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体;
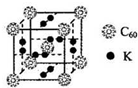
(2)K是19号元素,其原子核外有19个电子,4s电子为其价电子,且4s能级上只有一个电子;根据均摊法计算该晶胞中K原子和C60个数,从而确定化学式;
(3)同一周期元素,元素电负性随着原子序数增大而增大,同一主族元素其电负性随着原子序数增大而减弱;
NCl3分子中N原子价层电子对个数是4且含有一个孤电子对,据此判断该分子VSEPR模型;
Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以每个硅原子和其中两个硅原子形成共价单键,和另外的一个硅原子形成共价双键,据此计算分子中π键的数目.
解答 解:(1)原子晶体的熔点大于分子晶体,金刚石是原子晶体,C60是分子晶体,C60是分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所以能量较低,所以C60熔点低于金刚石,故答案为:不正确,因为金刚石是原子晶体,而C60是分子晶体;
(2)K是19号元素,其原子核外有19个电子,4s电子为其价电子,且4s能级上只有一个电子,所以其价电子排布式为4s1;
该晶胞中K原子个数=12×$\frac{1}{2}$=6,C60个数=1+8×$\frac{1}{8}$=2,所以K原子和C60个数之比=6:2=3:1,
故答案为:4s1;3:1;
(3)同一周期元素,元素电负性随着原子序数增大而增大,同一主族元素其电负性随着原子序数增大而减弱,所以电负性大小顺序是N>C>Si;
NCl3分子中N原子价层电子对个数是4且含有一个孤电子对,据此判断该分子VSEPR模型为正四面体;
Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以每个硅原子和其中两个硅原子形成共价单键,和另外的一个硅原子形成共价双键,所以平均每个Si60形成π键数目为:60×$\frac{1}{2}$=30,
故答案为:N>C>Si;正四面体;30.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、电负性大小比较、原子核外电子排布、分子空间构型判断等知识点,侧重考查学生分析判断、空间想象、计算能力,难点是晶胞计算.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①② | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧秸秆,还肥于田 | B. | 净化废水,循环利用 | ||
| C. | 低碳出行,植树造林 | D. | 开发风能,利用地热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
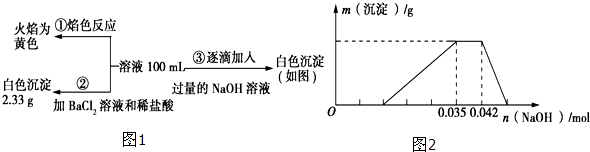
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98 g | B. | 18 g水中含有水分子数为NA | ||
| C. | O2的摩尔质量等于其相对分子质量 | D. | 1 mol CO的质量为28 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
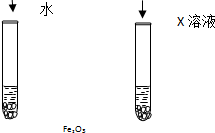 氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:
氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NH4Cl、Mg(NO3)2 | ||
| C. | NH4HCO3、KCl、NaCl | D. | KMnO4、NaCl、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com