
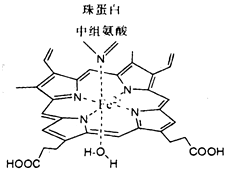
 红细胞中血红素结构如图所示,回答下列问题:
红细胞中血红素结构如图所示,回答下列问题: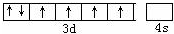 .
.分析 ①Fe2+的外围电子为3d6,据此书写轨道表示式;
②根据元素周期表电负性的递变规律比较电负性强弱;
③根据价层电子对互斥理论判断C原子杂化方式,价层电子对个数=σ键个数+孤电子对个数;
④有孤对电子的原子易形成配位键,Fe2+与N的结合弱,氮原子的电负性小,原子半径大,供给电子能力强.
解答 解:①Fe2+的核外电子排布为1s22s22p63s23p63d6,Fe2的外围电子为3d6,则轨道表示式[Ar] ,
,
故答案为: ;
;
②同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,故有:O>N>C>H,
故答案为:O>N>C>H;
③羧基中碳氧双键,C原子含有3个σ键,无孤电子对,碳的杂化方式为sp2杂化,
故答案为:sp2杂化;
④二氧化碳分子中氧原子核外有孤对电子,则血红素中Fe2+与CO2中氧原子与配位键形式结合,这种结合是可逆的,因氮原子的电负性小,原子半径大,供给电子能力比氧强,易形成配位键,
故答案为:氧;配位键;氮原子的电负性小,原子半径大,供给电子能力比氧强,易形成配位键.
点评 本题考查较为综合,涉及轨道表示式、电负性、杂化轨道方式、配位键等知识,易错点为④.注意氮原子的电负性小,原子半径大,供给电子能力比氧强,易形成配位键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
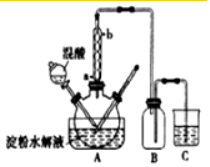
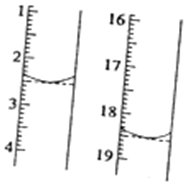
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl═NaCl+H2O | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com