
【题目】关于下列实验现象的说法不正确的是

A. 氨气是无色有刺激性气味的气体,密度比空气小
B. 实验1,由喷泉现象可知氨气极易溶于水且溶解速率快
C. 实验1,烧瓶溶液中的含氮微粒有:NH3、NH3·H2O和NH4+
D. 实验2,加热过程中温度和c(NH3·H2O)对NH3·H2O电离平衡移动方向的影响一致
【答案】D
【解析】
A. 氨气是无色有刺激性气味的气体,氨气的相对分子质量17,空气平均相对分子质量29,根据密度比等于相对分子质量之比,可知氨气密度比空气小,故不选A;
B. 由于氨气极易溶于水,一体积水可以溶解700体积氨气,且溶解速率快,可以形成较大的压强差,所以可以做喷泉实验,故不选B;
C.烧瓶溶液中存在NH3+H20![]() NH3.H2O
NH3.H2O![]() NH4++OH-,因此含氮微粒有:NH3、NH3·H2O和NH4+,故不选C;
NH4++OH-,因此含氮微粒有:NH3、NH3·H2O和NH4+,故不选C;
D.因为NH3·H2O不稳定受热易分解,加热过程中会让NH3·H2O分解,c(NH3·H2O)减小使电离平衡逆向移动;弱电解质的电离是吸热过程,升高温度促进电离平衡正向移动。由题中信息可知,加热后溶液的红色变浅,说明温度和c(NH3·H2O)对NH3·H2O的电离平衡的影响是不一致的,故选D;
答案:D


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)++3CO2 (g)的△H=______kJ/mol
Ⅱ.—定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2 L的密闭容器按甲、乙两种方式投入反应物发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)

甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内平均反应速率_______,此条件下该反应的平衡常数K= ____。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是: y____z(填或“>”“<”“ = ”),且y=_________(用含的等式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3 (g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:
C6H5CH=CH2(g)+CO(g) + H2O(g)”中乙苯的平衡转化率影响如图所示:

则△H_____(填“>”、“<”或“ = ”),压强p1、p2、p3从大到小的顺序是_____。
(3)CO可被NO2氧化:CO+NO2 =CO2+ NO。当温度高于225℃时,反应速率![]() 正=k正 c(CO) c(NO2),
正=k正 c(CO) c(NO2), ![]() 逆=k逆 c(CO2) c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为___________。
逆=k逆 c(CO2) c(NO), k正、k逆分别为正、逆反应速率常数。在上述温度范围内, k正、k逆与该反应的平衡常数K之间的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验: ①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加几滴0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加几滴0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. ③中颜色变化说明AgCl转化为AgI
C. 实验可以证明AgI比AgCl更难溶
D. 滤液b中不含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究表明As2O3在医药领域有重要应用。某小组从工业废料中提取As2O3设计流程如下:

已知:H3AsO3为弱酸,热稳定性差。
(1)写出一条“碱浸”时提高浸取率的方法____;“碱浸”中H3AsO3转化成Na3AsO3的离子方程式为____。
(2)“氧化”时常在向混合液中通入O2时对体系加压,目的是____。
(3)“沉砷”过程中有如下反应:
①![]()
![]() <0
<0
②![]()
![]() >0
>0
沉砷率与温度关系如图。沉砷最佳温度为____,高于85℃时,沉砷率下降的原因是____。

(4)“还原”过程中获得H3 AsO3的化学反应方程式为____;“操作A”为:____、过滤;滤液Ⅱ的主要成分是____。
(5)若每步均完全反应,“氧化’’和“还原”时消耗相同条件下O2和SO2体积分别为xL、yL,则废水中n(H3AsO3):n(H3AsO4)=____(写出含x、y的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)![]() CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)![]() 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列仪器组装一套石油分馏的装置,并进行相关实验,可以得到汽油和煤油。

(1)写出下列仪器的名称:
①________;②________;③________。
(2)将以上仪器按从左到右的顺序,用字母a、b、c……进行连接:e接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)接(____)。
(3)仪器②中A是________(填“进水口”或“出水口”,下同),B是________。
(4)蒸馏时,温度计水银球应在________(位置)。
(5)在①中注入原油后,加几片碎瓷片的目的是_______
(6)在实验结束后,为了探究石油中是否含有烯烃,某学生用③中的物质做了一个探究实验,其操作、现象及结论是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A分子的球棍模型和B分子的比例模型,回答下列问题:

(1)A和B的关系是 。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式 。
(3)写出B分子和金属钠反应的化学方程式 。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。

(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850 ℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) ΔH=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850 ℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
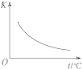
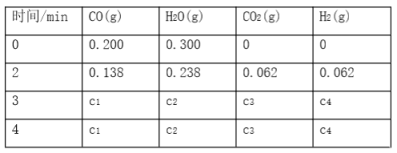
已知:850 ℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是________。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”“=”或“<”)。
(3)若在850 ℃时向反应容器中充入H2O(g),K值________________(填“增大”“减小”或“不变”)。
(4)上表中c2为________________,CO(g)的转化率为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com