
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.①、②、③的反应类型分别为卤代、水解、消去
C.A能使高锰酸钾酸性溶液褪色
D.A的结构简式是CH2=CHCH2CH3
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对铜、铁与硝酸的反应进行实验探究。回答下列问题:
(1)验证铜与硝酸的反应(实验装置如图所示)。已知仪器a中盛有足量的一定浓度的硝酸溶液,试管b中盛有6.4g铜片。
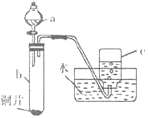
①仪器a的名称是___。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有___。
③待试管b中铜片完全消失。如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是___ g。
(2)探究铁与稀硝酸的反应。用5.6gFe粉和含有0.3molHNO3的稀硝酸进行实验,若两种物质恰好完全反应,且HNO3只被还原成NO。
①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为___。
②Fe粉与稀硝酸反应生成硝酸亚铁的离子方程式为___。
③反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=___。
④标准状况下,生成NO气体的体积为___L(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答。
(1)①写出MgO的名称________________;②写出乙炔的结构式______。
(2)写出NaHCO3受热分解的化学方程式______________。
(3)写出Cl2与NaOH溶液反应的离子方程式_____________。
(4)海带中提取碘的过程中,将I-氧化生成I2时,若加入过量的氯水,则Cl2将I2氧化生成HIO3,同时还有一种强酸生成,写出该反应的化学方程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机盐X(仅含两种元素)可通过单质甲与Ca(OH)2浊夜共热的方法来制备,某同学为探究X的组成和性质,设计了如下实验(流程图 中部分产物已略去)。
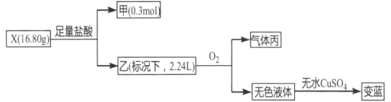
已知:气体乙在标况下的密度为1.52 g·L-1,气体丙无色、有刺激性气味,能使品红溶液褪色。
(1)X的化学式为____,乙的电子式为________
(2)X与足量盐酸反应的化学方程式为___________
(3)在澄清石灰水中通入过量气体丙反应的离子方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水电离出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN变红色的溶液:Na+、K+、Al3+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A有下列变化:
的有机物A有下列变化:

其中B、C的相对分子质量相等,下列有关说法错误的是( )
A.C和E互为同系物
B.符合题目条件的A共有4种
C.D既能发生氧化反应,又能发生还原反应
D.符合题目条件的B共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.氢键属于一种较强的分子间作用力,只能存在于分子之间
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na<Mg<Al
D.晶格能由大到小:NaF>NaCl>NaBr>Nal
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
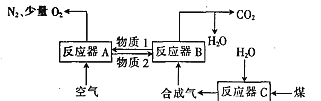
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
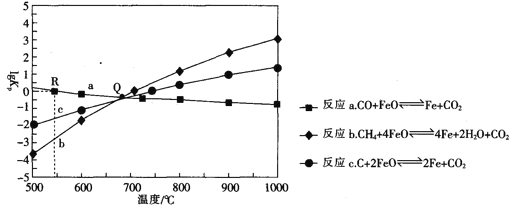
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com