
【题目】I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________(填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3![]() H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是 ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
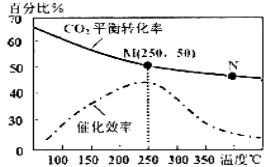
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______(填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(3)若在500℃时,投料![]() =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
【答案】I.(1)A、(2)<;
II.(1)①c(H+)>c(H2PO3-)>c(HPO32-)②H3PO3+OH—=H2PO3—+H2O
III.(1)-127.8;(2)①③⑤;
IV:(3)主要有三种情况:
第一种情况:设c(NO)=1mol·L-1,则K=160;
第二种情况:设c(NO)=amol·L-1,则K=160/a;
第三种情况:设c(NO)=amol,则K=160V/a
【解析】
试题分析:I.(1)A.根据物料守恒,c(A2-)+c(HA-)=0.1mol/L,故A错误;
B.根据质子守恒得:c(OH-)=c(H+)+c(HA-),故B正确;
C.0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D.原子守恒可以得出c(Na+)=2c(A2-)+2c(HA-),故D正确;故答案为A;
(2)因为0.1molL-1NaHA溶液的pH=2,则由HA-H++A2-可知,电离出0.01mol/LH+;而0.1molL-1H2A溶液,H2A=H++HA-,电离出H+0.1mol/L和HA-0.1mol/L,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L;
Ⅱ.①0.1000molL-1的H3PO3溶液pH的读数为1.6,氢离子浓度小于亚磷酸浓度,所以亚磷酸是二元弱酸,在水中分步电离,且第一步电离程度大于第二步,两步电离中都有氢离子生成,所以氢离子浓度最大,离子浓度大小顺序是c(H+)> c(H2PO3-)> c(HPO32-);
②亚磷酸是二元酸,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,所以该反应方程式为:H3PO3+OH-=H2PO3-+H2O;
Ⅲ.(1)已知:H2(g)的燃烧热为285.8kJmol-1,则其热化学方程式为:H2(g) + 1/2O2(g) = H2O(l) △H=-285.8 kJ/mol①;CH2=CH2(g)的燃烧热为1411.0 kJmol-1,其热化学方程式为:C2H4(g) + 3O2(g) = 2H2O(l) + 2CO2(g) △H=-1411.0 kJ/mol ②;H2O(g)=H2O(l) △H=-44.0 kJmol-1③;利用盖斯定律将①×6-②-③×4可得:6H2(g)+2CO2(g)CH2═CH2(g)+4H2O(g) △H=-127.8kJmol-1;
(2)①化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故①不正确;②升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故②正确;③温度低于250℃时,随温度升高平衡逆向进行乙烯的产率减小,故③不正确;④温度越高反应速率越快,N点温度比M点高,则N点正反应速率一定大于M点正反应速率,故④正确;⑤为提高CO2的转化率,平衡正向进行,反应是放热反应,低的温度下进行反应,平衡正向进行,但催化剂的活性、反应速率减小,故⑤不正确;故答案为①③⑤ ;
Ⅳ.若在500℃时,投料![]() =1,NO的转化率为80%,
=1,NO的转化率为80%,
设c(NO)=1molL-1,
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g).
2CO2(g)+N2(g).
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.8 0.8 0.8 0.4
平衡量(mol/L) 0.2 0.2 0.8 0.4
则此温度时的平衡常数K=![]() =160;
=160;
设c(NO)=amolL-1,
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol/L) a a 0 0
变化量(mol/L) 0.8a 0.8a 0.8a 0.4a
平衡量(mol/L) 0.2a 0.2a 0.8 a 0.4a
则K=![]() =160/a;
=160/a;
设n(NO)=amol,容器的容积为V L,
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol/L) a/V a/V 0 0
变化量(mol/L) 0.8a/V 0.8a/V 0.8a/V 0.4a/V
平衡量(mol/L) 0.2a/V 0.2a/V 0.8a/V 0.4a/V
则K=![]() =160V/a。
=160V/a。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】在1L 1mol/L的氨水中,下列有关说法正确的是
A.NH3·H2O为1mol ,溶质质量为35g
B.NH4+为1mol ,溶质质量为18g
C.溶解状态的NH3分子为1mol,溶质质量为17g
D.氨水中NH3、NH3·H2O、NH4+三种微粒总的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序 .
(2)ZW2的电子式是 .
(3)实验室制备Y的最高价氧化物的水化物的离子方程式是
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br﹣的物质的量之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的知识说法正确的: ( )
A. Fe(OH)3的胶体是带有正电荷,所以通上直流电后会发生电泳现象
B. 用丁达尔现象可鉴别氯化钠的溶液和淀粉溶液
C. 在沸水中加入饱和FeCl3溶液制取胶体化学方程式为:FeCl3+H2O=Fe(OH)3↓+3HCl
D. 用过滤的方法可以分离溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
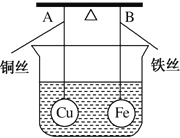
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药品羟苯水杨胺的合成路线如下。

已知:① ;
;
② ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)羟苯水杨胺的分子式为______,F含有的官能团名称是________。
(2)A的名称为___________。
(3)A→B所需试剂为______;D→E的反应类型属于_________。
(4)B→C反应的化学方程式为_____________。
(5)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的共有_____种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为l:2:2:1的同分异构体的结构简式是__________。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
a极板 | b极板 | a电极 | Z溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 正极 | CuCl2 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素,A、B、C、D、E的核电荷数依次增大,其中B、E同主族,A元素的氢化物是被称为高效、较纯净的燃料;B元素是地壳中含量最多的元素;C、D、E三种原子的最外电子层电子数之和为10,且这三种元素的最高氧化物对应水化物之间两两皆能反应,均生成盐和水。
(1)推断A、B、C、D、E五种元素,写出下列元素名称:
B:________ C:________ E:_________
(2)C2E化合物名称为_____________;
(3)写出化合物AB2的电子式_____________
(4)写出D的单质与E的最高价氧化物的水化物的稀溶液反应的离子方程式为
_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com