
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
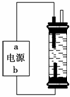
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
下列不属于电离方程式的是( )
A.2H2O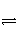
 H3O++OH-
H3O++OH-
B.H2O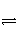
 H++OH-
H++OH-
C.CH3COOH+H2O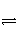
 CH3COO-+H3O+
CH3COO-+H3O+
D.CH3COOH+NaOH===CH3COONa+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是( )
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
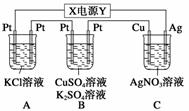
(1)电源中X极是__________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前[CuSO4]=____________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=
__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,在溶液里能大量共存,且溶液为无色透明的是( )
A.NH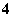 、NO
、NO 、Al3+、Cl-
、Al3+、Cl-
B.Na+、SiO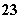 、NO
、NO 、Fe3+
、Fe3+
C.Na+、MnO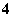 、K+、SO
、K+、SO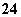
D.Na+、HCO 、SO
、SO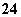 、Al3+
、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告请填写有关空白):
一)测定目的:测定工厂工业废水中的游离态氯的含量
二)测定原理:Cl2+2KI===2KCl+I2;I2+2Na2S2O3===2NaI+Na2S4O6
三)实验用品及试剂:
1)仪器和用品自选,略)
2)试剂:指示剂________填名称),KI溶液,浓度为0.010 mol/L 的标准Na2S2O3溶液,蒸馏水等。
四)实验过程:
1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液足量),滴入指示剂2~3滴。
2)取碱式滴定管经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mL/L Na2S2O3溶液待用。
3)将锥形瓶置于滴定管下方进行滴定,眼睛注视______直至滴定终点,滴定至终点的现象是__________________________。
五)数据记录与处理:请在下面表格中的有括号的横线上填上必要的物理量,不必填数据)
| 滴定 次数 | ______) | ____________) | |||
| ______) | ______) | ______) | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 |
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为________,从实验过程分析,此浓度比实际浓度________填“偏大”、“偏小”或“相等”),造成误差的原因是
________________________________________________________若认为没有误差,该问可不答)。
六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是________填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
查看答案和解析>>
科目:高中化学 来源: 题型:
分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是( )
A.H2O、AgNO3、HNO3 B.H2O、NaOH、HNO3
C.H2O、NaOH、HCl D.H2O、KOH、HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com