
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | 2.9×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液①C(CH3COONa) ②C(NaClO) ③C(NaHCO3) ④C(Na2CO3)pH关系为:④>②>③>① | |
| B. | 少量CO2通入次氯酸钠溶液中:CO2+ClO-+H2O═HClO+HCO3- | |
| C. | 新制氯水中Cl2+H2O?HCl+HClO为适当增大HClO 的浓度,可加入少量固体Na2CO3 | |
| D. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
分析 A.电离平衡常数越大,酸性越强,电离程度越大;
B、强酸能和弱酸盐反应生成弱酸;
C、在下列平衡:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应平衡正向进行;
D、先计算氢氧根离子浓度,水电离出的氢离子浓度等于氢氧根离子浓度.
解答 解:A.由表格中的数据可知,醋酸电离平衡常数最大,碳酸氢根离子的电离平衡常数最小,酸性越强,则对应盐的水解越弱,等物质的量浓度溶液中氢氧根离子浓度越小,则等浓度的三种溶液的pH关系为:④>②>③>①,故A正确;
B、酸性H2CO3>HClO>HCO3-,少量CO2通入次氯酸钠溶液中反应生成碳酸氢钠和次氯酸,离子方程式为:CO2+H2O+ClO-═HCO3-+HClO,故B正确;
C、在化学平衡中:C12+H2O?H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,会和溶液中的盐酸反应平衡正向进行,次氯酸酸性小于碳酸,不与碳酸钠反应,次氯酸浓度增大,故C正确;
D、该溶液中c(OH-)=10d-14mol/L,水电离出的c(H+)=c(OH-)=10d-14mol/L,故D错误;
故选D.
点评 本题考查电离、水解及溶液中离子浓度的关系,综合性较强,题目难度中等,注意题干中数据的应用来解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
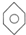 和
和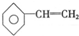 ; E.
; E.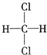 和
和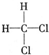 ; F.
; F.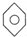 和
和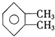 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1mol Al3+含有的核外电子数为0.3NA | |
| B. | 1 mol氯化钠晶体中含有NA个阴离子 | |
| C. | 室温下,pH=12的氢氧化钡溶液所含氢氧根离子数为0.2NA | |
| D. | 电解足量硫酸铜溶液,当电路中转移NA个电子时,阳极生成氧气(标况下)5.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
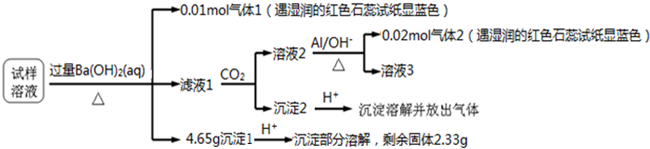
| A. | 沉淀2为氢氧化铝 | |
| B. | Cl-一定存在,且c(Cl?)≥0.05mol | |
| C. | 该试样溶液中一定存在的离子有NH4+、Mg2+、Al3+、SO42-和NO3- | |
| D. | 试样中可能存在Na+、Cl-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的c(H+)=1×10-13mol/L溶液中:K+、Na+、AlO2-、CO32- | |
| D. | 含1.0mol•L-1Al3+的溶液中:Na+、HCO3-、SO42-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50% | B. | 80% | C. | 88% | D. | 95% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 阳极产生KOH | |
| B. | 阴极产生KOH | |
| C. | 大量H+ 通过离子交换膜从左侧到右侧 | |
| D. | 大量K+通过离子交换膜从右侧到左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
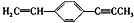 ,说法正确的是( )
,说法正确的是( )| A. | 最多只能有9个碳原子在同一平面上 | |
| B. | 有6个碳原子可能在同一直线上 | |
| C. | 最多有4个碳原子在同一直线上 | |
| D. | 所有原子一定都在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com