
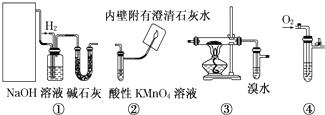
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、①④⑥ | B、②③⑤ |
| C、①③⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液不含SO42- |
| C、丙溶液不含Cl- |
| D、丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
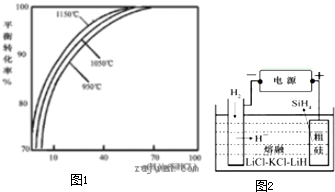 多晶硅是太阳能光伏产业的重要原料.
多晶硅是太阳能光伏产业的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:
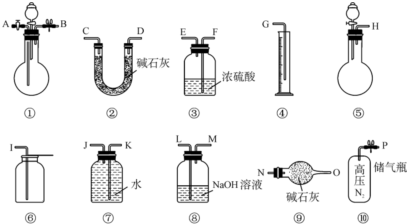
查看答案和解析>>
科目:高中化学 来源: 题型:


| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2和SO2都能使石蕊试液和品红褪色 |
| B、实验室可用NaOH溶液处理NO2和HCl废气 |
| C、实验室可用浓硫酸干燥氨气 |
| D、Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com