
【题目】实验室欲用18mol/L的浓硫酸配制500mL 3mol/L的稀硫酸,下列说法正确的是( )
A.应用量筒量取83.30mL的浓硫酸
B.在烧杯中溶解后,应立即转移至容量瓶中
C.加水定容时,若俯视刻度线,会使所配溶液浓度偏低
D.若未洗涤烧杯内壁并将洗涤液转移至容量瓶中,会使所配溶液浓度偏低
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
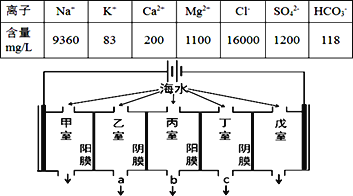
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为b
D. 淡化过程中易在戊室形成水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃A能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C、D、E、F、G转化关系如下(以下变化中,有些反应条件及产物未标明)。其中G是天然有机高分子化合物,C、F能发生银镜反应,E分子具有浓郁的果香味,其相对分子质量为88。
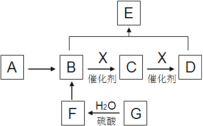
(1)写出A分子的电子式:__________;G的分子式:__________
(2)写出分子式与B相同,但不能与金属钠反应的物质的结构简式__________
(3)写出B+D→E的化学方程式:__________
(4)B→C的反应类型为__________;物质C、F__________(填“是”或“不是”)同一类物质。
(5)F→B过程中还产生了另外一种气态物质M,请简述实验室检验气体M的方法:__________。
(6)工业上制备物质E的方法有多种。其中A与D以物质的量比1:1反应生成E,请判断其反应类型为__________。
(7)E的同分异构体中,能与Na反应,又能与Na2CO3溶液反应的物质是__________(用结构简式书写一种即可)
(8)物质X可由如图装置制备。
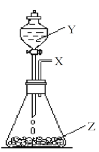
①若Z是一种淡黄色固体,则锥形瓶中发生反应的化学方程式是______________________________
②若Z是一种黑色粉末,则物质Y是__________,Z的作用是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与 pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与 pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(选填序号,下同),水的电离程度相同的是_________;
(2)若将②、③混合后所得溶液 pH=7,则消耗溶液的体积:②______③(选填“>”、“<”或“=”,下同);若将②、③溶液等体积混合后,所得溶液 pH_____________7。
(3)若将①、④溶液按体积比为2:1混合后,所得溶液pH______7(选填“>”、“<”或“=”)此时溶液中除水分子外的各微粒的浓度由大到小的顺序为:__________;将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈_________(填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
科目:高中化学 来源: 题型:
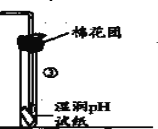
【题目】用如图实验装置探究铜丝与过量浓硫酸的反应及SO2的部分化学性质。
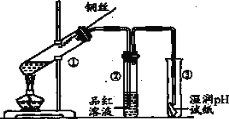
(1)试管①中发生反应的化学反应方程式为_____________________。
(2)装置③证明SO2溶液显__________性,同时证明SO2_________(填“能”或“不能”)漂白pH试纸。
(3)实验完毕,取下试管②并加热,可观察的现象是____________,该实验可以达到的目的是_______。
(4)实验初期发现大试管内有白色沉淀生成,该沉淀的化学式为_____________。
(5)终止试管①中反应的方法是_____________。
(6)基于环境保护的考虑,如图是某学生提出的实验改进方法,其中棉花团上应浸取的试剂为_________(任填一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温,0.1mol/Lt溶液与0.1mol/L u溶液的pH均为1,下列说法正确的是( )
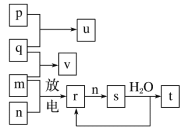
A. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
B. Y、W的氧化物对应的水化物均为强酸
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为2∶1
D. v的电子式可表示为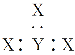
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com