
【题目】下列叙述正确的是( )
A.钠的摩尔质量等于它的相对原子质量
B.CH4的摩尔质量为16 g/mol
C.22.4 L任何气体的物质的量均为1 mol
D.1 mol 任何物质均含有NA个分子
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并检验氯气的氧化性,同时用电解产生的H2还原CuO粉末来测定Cu的相对原子质量。

(1)写出电解饱和食盐水的离子方程式_________________________________。
(2)为完成上述实验,正确的连接顺序为A连_______;B连_______ (填写导管口字母)。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是下列试剂中的___________。
a.酸性高锰酸钾溶液 b.淀粉碘化钾溶液 c.亚硫酸钠溶液 d.氯化亚铁溶液
(4)丙装置的c瓶中盛放的试剂为___________,作用是______________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:___________方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为________________。
②不合理的方案会造成测定结果___________(填“偏低、偏高或无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为___________
(2)B、C、N、O四种元素第一电离能由小到大的顺序为_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示:
卤化物 | BF3 | BCl3 | BBr3 | BI3 |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:_________________。
③制备环硼氨烷的方法如下:
![]()
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________________;与B3N3H6互为等电子体的分子的结构简式为___________________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。

①晶胞中每个氮原子周围与其最近且等距离的硼原子有_____个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中, B原子的坐标参数分别有:B(0,0,0),B(![]() ,0,
,0, ![]() );B(0,
);B(0, ![]() ,
, ![]() )等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
③已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为____g·cm-3(设NA为阿伏加德罗常数值,只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3·H2O)
B. 用少量水稀释0.1mol·L-1氨水时;溶液中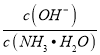 减小
减小
C. 将Na2CO3溶液从20℃升温至30℃,溶液中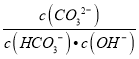 增大
增大
D. pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素的原子结构及性质如下表所示:
元素 | 结构及性质 |
A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
B | B原子最外层电子数是内层电子总数的1/5 |
C | C是常见化肥的主要元素,单质常温下呈气态 |
D | D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质 |
E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
F | F在周期表中可以排在IA族,也有人提出排在VIIA族 |
(1)A元素在周期表中的位置为第_____周期_____族。
(2)B与C形成的化合物的化学式为______,它属于____(填“离子”或“共价”)化合物。
(3)F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y。区别X与Y的水溶液的实验方法是_________________________________________。
(4)C与E都是较活泼的非金属元素,两者的非金属性强弱比较:_____>______(用化学符号回答),请例举出一个判断二者非金属性强弱的证据是____________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:
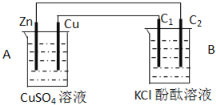
(1)判断装置的名称:A池为_________,B池为___________。
(2)铜极为______极,电极反应式为_________,石墨棒C1为___极,电极反应式为______________________,石墨棒C2附近发生的实验现象为___________________。
(3)当C2极析出224mL气体(标准状态时),锌的质量变化(增加或减少)_____g,CuSO4溶液的质量变化了(增加或减少了)______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
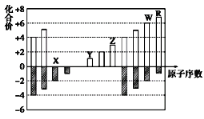
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素。其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为2∶3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z元素在元素周期表中的位置是_____________________。
(2)化合物B2A4的结构式为____________________。
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为_____
(4)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为________________________________________________,由此可得出NO与ZX2的还原性大小关系为________________(填相应化学式)。
(5)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的化学方程式为________。
(6)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的离子反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器可以加热的是( )
①蒸馏烧瓶;②容量瓶;③蒸发皿;④试管;⑤分液漏斗;⑥量筒;⑦锥形瓶
A.①③④⑦B.②④⑥⑦C.③④⑤D.②③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com