
16.8g NaHCO3和7.8g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃.最后容器内的物质是()
| A. | Na2CO3、Na2O2和O2 | B. | Na2CO3、O2和H2O(g) | |
| C. | Na2CO3、CO2、O2和H2O(g) | D. | NaHCO3、Na2CO3和O2 |
| 钠的重要化合物;化学方程式的有关计算. | |
| 专题: | 几种重要的金属及其化合物. |
| 分析: | 在密闭容器中充分加热,2NaHCO3 |
| 解答: | 解:2NaHCO3 168 44 18 16.8 g 4.4g 1.8 g 2CO2+2Na2O2=2Na2CO3+O2, 88 156 4.4g 7.8g 7.8g Na2O2恰好与NaHCO3分解产生的4.4gCO2完全反应生成Na2CO3和O2.所以最后容器内的物质是Na2CO3、O2、H2O(g), 故选B. |
| 点评: | 本题考查钠重要化合物性质、混合物的有关计算,难度中等,注意过氧化钠与水、二氧化碳反应的性质,注意转化为二氧化碳、水与过氧化钠反应的先后问题进行的解答. |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
已知α氨基酸与亚硝酸(HNO2)反应生成α羟基酸。如:
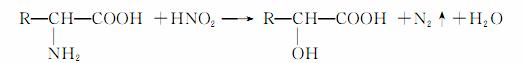 试根据下列6种有机物之间的转化关系,回答有关问题:
试根据下列6种有机物之间的转化关系,回答有关问题:
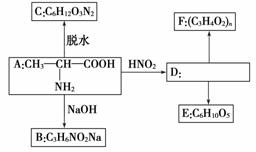
(1)写出有机物B和E的结构简式。
B:____________________,E:____________________。
(2)写出下列反应的化学方程式。
①A→C:________________________________________________________________________。
②D→F:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。
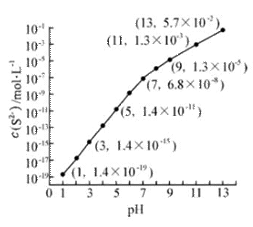
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
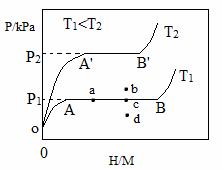
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min。反应的焓变△HⅠ_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为_________。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为()
| A. | 0mL | B. | 0.672mL | C. | 1.34mL | D. | 2.240mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是()
| A. | 参加反应的CO2的体积为0.224a L | |
| B. | 用上述数据不能确定NaOH溶液的物质的量浓度 | |
| C. | 若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3 | |
| D. | b可能等于a、小于a或大于a |
查看答案和解析>>
科目:高中化学 来源: 题型:
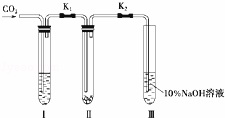
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应.在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化.
实验乙:潮湿的二氧化碳和过氧化钠的反应.在试管Ⅰ内装入试剂Y,其他操作同实验甲.观察到木条复燃,且Ⅱ中的淡黄色变为白色.
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是防止.
(2)在实验甲中,试剂X是浓硫酸;在实验乙中,试剂Y是.
(3)根据上述两个实验现象,得到的结论是.
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用(填编号).
A.大理石B.小苏打C.烧碱D.盐酸E.稀硫酸F.稀硝酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.化学变化过程是原子的重新组合过程
B.化学反应的焓变用ΔH表示,单位是kJ·mol-1
C.化学反应的焓变ΔH越大,表示放热越多
D.化学反应中的能量变化不都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记)。含有手性碳原子的物质通常具有光学活性。
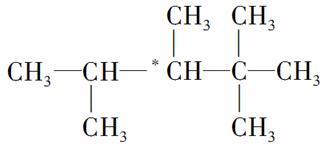
回答下列问题:
(1)烷烃X的名称是________;其一氯代物共有________种(不考虑立体异构,下同)。
(2)具有光学活性且式量最小的烷烃的化学式是________,其共有________种结构。
(3)某芳香烃A可经过如下反应得到一种热塑性塑料SAN(两种单体1:1共聚产物)。
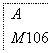
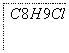
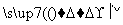

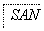
写出上述由A制备SAN的化学反应方程式:
____________________________________________________
_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com