
【题目】航天飞船可用肼(N2H4)作动力源.已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
A.肼(N2H4)分子中只存在极性共价键
B.该反应中肼作还原剂
C.该反应的反应物总能量高于生成物的总能量
D.此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等可以相互转化,关于化学能与其他能量相互转化的说法正确的是( ) 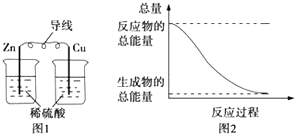
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为吸热反应
C.化学反应中能量变化的主要原因是化学键的断裂与生成
D.中和反应中,反应物的总能量比生成物的总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 在多电子的原子里,能量高的电子通常在离核近的区域内活动
B. 核外电子总是先排在能量高的电子层上,由里向外逐层排布
C. 两种微粒,若核外电子排布完全相同,则其化学性质不一定相同
D. 微粒的最外层只能是8个电子才稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代生活中出现了“铁强化酱油”、“高钙牛奶”、“富硒茶叶”、“含氟牙膏”等商品,这里的铁、钙、硒、氟应理解为( )
A.元素 B.单质 C.分子 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2的分解做了如下探究:下表是该实验小组研究影响H2O2分解速率的因素时
记录的一组数据:用10mL H2O2制取150mL(标准状况下)O2所需的时间(s)
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂加热 | 360 | 480 | t | 720 |
MnO2催化剂加热 | 10 | 25 | 60 | 120 |
(1)①该实验小组在设计方案时,考虑了浓度、、等因素对H2O2分解速率的影响.
上述因素对H2O2分解速率的影响分别是:
②推测t(s)的范围为 .
(2)下列有关催化剂的说法中正确的是(填序号)
A.催化剂不参与反应,反应前后催化剂的性质和质量都不变
B.催化剂在化学反应前后化学性质和质量都不变
C.催化剂能使不起反应的物质发生反应
D.催化剂能改变化学反应速率
E.任何化学反应都需要催化剂
F.催化剂具有高度的选择性(或专一性)
(3)将质量相同但聚集状态不同的MnO2分别加入15mL 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
催化剂MnO2 | 操作情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
①写出上述实验中发生反应的化学方程式 .
②实验结果表明,催化剂的催化效果与有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的实验装置不能完成实验目的是( )
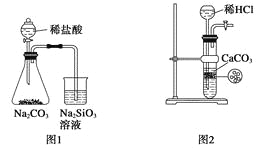
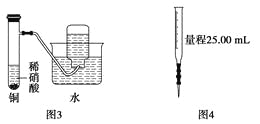
A. 图1为证明非金属性强弱:Cl>C>Si
B. 图2为制备少量CO2并控制反应
C. 图3为制备并收集少量NO气体
D. 图4量取0.10 mol·L-1KOH溶液20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________,A的转化率为________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________(填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________(填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则 :
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________;
③电池放电后,溶液的pH不断________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com