
| A. | Br | B. | K | C. | S | D. | Cl |
分析 元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;同一周期元素,其非金属性随着原子序数增大而增强,同一主族元素,其非金属性随着原子序数增大而减弱,据此分析解答.
解答 解:元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;同一周期元素,其非金属性随着原子序数增大而增强,同一主族元素,其非金属性随着原子序数增大而减弱,
这几种非金属元素非金属性强弱顺序是Cl>Br>S,所以其最高价氧化物的水化物酸性最强的是Cl元素,故选D.
点评 本题考查元素周期律,为高频考点,侧重考查学生对知识的灵活运用,明确同一周期、同一主族元素递变规律及非金属性与其最高价氧化物水化物酸性关系是解本题关键,知道非金属性强弱判断方法,题目难度不大.


科目:高中化学 来源: 题型:实验题
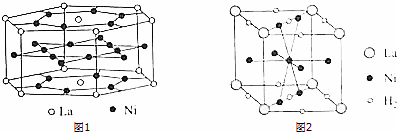
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
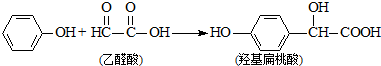
| A. | 该反应是加成反应 | B. | 苯酚和羟基扁桃酸是同系物 | ||
| C. | 该反应是取代反应 | D. | 乙醛酸不能与 NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
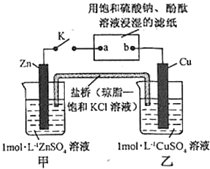
| A. | Cu 电极上发生还原反应 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | 片刻后甲池中 c(SO42-)增大 | D. | 片刻后可观察到滤纸 b 点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | CrO3 | C. | Cr2(SO4)3 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铝和纯硝酸反应 | |
| B. | 氯化铝与氢氧化钠反应,过滤得沉淀,再加稀HNO3 | |
| C. | 用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | AlCl3溶液和Ba(NO3)2溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com