
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
分析 难溶电解质的溶解平衡为动态平衡,Ksp为平衡常数,只受温度的影响,Ksp越大,说明越易溶解,以此解答该题.
解答 解:A.难溶电解质在溶液中达到沉淀溶解平衡时生成沉淀的速率和沉淀溶解的速率相等,且不等于零,即沉淀溶解平衡是一种动态平衡,故A正确;
B.Ksp是温度的常数,只随温度改变而改变,不同物质的溶解能力不同,与物质本身的性质有关,故B正确;
C.溶度积只受温度的影响,故C错误;
D.难溶电解质的Ksp数值越大,可说明越易溶于水,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析能力的考查,注意Ksp是温度的常数,只随温度改变而改变,题目难度不大.


科目:高中化学 来源: 题型:选择题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙元素 | B. | 碘元素 | C. | 铁元素 | D. | 钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×10-13 mol•L-1 | B. | 7.3×10-13 mol•L-1 | ||
| C. | 2.3 mol•L-1 | D. | 3.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1 L0.2 mol•L-1 HF溶液中加入1 L 0.2 mol•L-1 CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温AgCl若在NaI溶液中开始转化为AgI,NaI浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
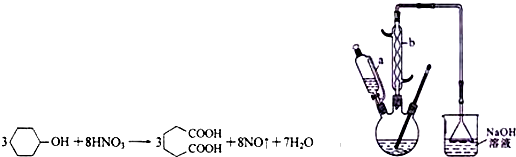
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
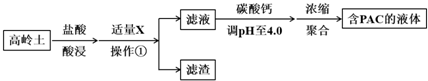
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
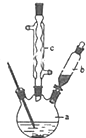 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线: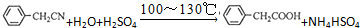

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com