
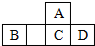
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |
分析 A、B、C、D均为短周期元素,从其相对位置判断,C应为第三周期,C元素原子核外电子总数是其最外层电子数的3倍,故C为P元素,那么A为N元素,B为Al元素,D为S元素,结合选项解答即可.
解答 解:A为N,B为Al,C为P,D为S,
A、元素的非金属性越强,其氢化物越稳定,非金属性N>P,故NH3>PH3,故A错误;
B、元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性S>P,故酸性:H2SO4>H3PO4,故B错误;
C、氢氧化铝为两性强氧化物,能与硫酸反应,故C正确;
D、常温下氮气为气态,故D错误,
故选C.
点评 本题主要考查结构位置性质关系应用,难度不大,注意把握周期表的结构,注意元素非金属性强弱的比较,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
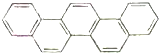 第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )
第二十九届奥林匹克夏季运动会于2008年8月8日-24日在北京隆重举行并获得巨大成功.如图是酷似奥林匹克旗中五环的一种有机物,被称之为奥林匹克烃.下列说法正确的是( )| A. | 该有机物的一氯代物共有四种 | |
| B. | 该有机物是只含非极性键的非极性分子 | |
| C. | 该有机物属于芳香族化合物,是苯的同系物 | |
| D. | 该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com