
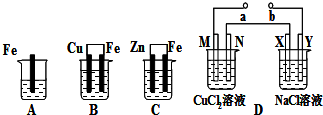
分析 (1)原电池中失电子的极是负极得电子的极是正极;
(2)金属的腐蚀速率:原电池的负极腐蚀速率>化学腐蚀>原电池的正极腐蚀速率;
(3)根据电极反应式来计算转移电子和消耗金属量的关系;
(4)电解池中和电源的负极相连的是阴极,和电源的正极相连的是阳极;解池的阳极不属于活泼电极时,电解质中的阴离子在该极发生失电子的氧化反应;
(5)串联电路中转移的电子数是相等的,根据电子转移的多少来计算析出生成物的物质的量.
解答 解:A是金属铁直接和硫酸铜之间的反应,B是原电池,金属铁为负极,金属铜为正极,C为原电池,金属锌是负极,金属铁是正极,D中在XY两边各滴入几滴酚酞试液,X极附近首先变红,说明X附近是氢离子放电了,所以X极是阴极,所以Y极是阳极,b极是电源的正极,a极是电源的负极,M极是阴极,N是阳极.
(1)B中Cu极为正极,发生铜离子得电子的还原反应,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)金属的腐蚀速率:原电池的负极腐蚀速率>化学腐蚀>原电池的正极腐蚀速率,即反应速率最快的是B,最慢的是C,所以速率由快到慢的顺序为:B>A>C,故答案为:B>A>C;
(3)C中负极反应是:Zn-2e-→Zn2+,被腐蚀金属锌的质量是32.5g即0.5mol时,转移电子数是1mol,故答案为:1mol;
(4)M极是阴极,a极是电源的负极,电池D中N极是阳极,氯离子发生失电子的氧化反应,电极反应式为:2Cl--2e-=Cl2↑,故答案为:负;2Cl--2e-=Cl2↑;
(5)D中在M、N、X、Y各电极上的电极反应分别为:M、Cu2++2e-→Cu,N、2Cl-→Cl2↑+2e-,X、2Cl-→Cl2↑+2e-,Y、2H++2e-→H2↑,当转移电子的物质的量相等时,生成物的物质的量也相等,所以生成物的物质的量之比为1:1:1:1,故答案为:1:1:1:1.
点评 本题考查学生电化学中原电池和电解池的工作原理知识,可以根据所学知识进行回答,难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是两种核素 | |
| B. | 纤维素和淀粉互为同分异构体 | |
| C. | CH3COOCH2CH3和CH3CH2OOCCH3是同物质 | |
| D. | CH3CH2COOH可看成是由-C2H5和-COOH两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的NaCl晶体不能导电,但NaCl是电解质 | |
| B. | 食盐水能导电,所以食盐水是电解质 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 一种物质如果不是电解质,那么它一定是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应的水化物的碱性:Y>R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com