
| 事实 | 非金属性强弱 | |
| A | CH4受热分解的温度比SiH4高 | C>Si |
| B | C与SiO2在高温下反应生成Si和CO | C>Si |
| C | 稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体 | Cl>Si |
| D | H2SO3是中强酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A、氢化物稳定,中心元素的非金属性越强;
B、在高温条件下,C能置换出SiO2中的Si,C表现出金属;
C、稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体,说明盐酸的酸性强于硅酸,而盐酸不是含氧酸,所以无法比较氯与硅的非金属性强弱;
D、H2SO3不是最高价含氧酸,所以无法比较硫与硅的非金属性强弱.
解答 解:A、氢化物稳定,中心元素的非金属性越强,因为CH4受热分解的温度比SiH4高,所以非金属性:C>Si,故A正确;
B、在高温条件下,C能置换出SiO2中的Si,C表现出金属性,不能用该反应比较非金属性强弱,故B错误;
C、稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体,说明盐酸的酸性强于硅酸,而盐酸不是含氧酸,所以无法比较氯与硅的非金属性强弱,故C错误;
D、H2SO3不是最高价含氧酸,所以无法比较硫与硅的非金属性强弱,故D错误;
故选A.
点评 本题考查非金属元素在周期表中的位置及性质递变规律和酸性比较等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:填空题
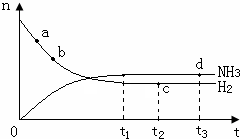 氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等.请回答下列问题:| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 | ||
| N2 | H2 | NH3 | ||
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
| 容器 | c(CO2) /mol•L-1 | c(H2) /mol•L-1 | c(CH3OCH3) /mol•L-1 | c(H2O) /mol•L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
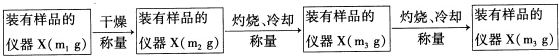
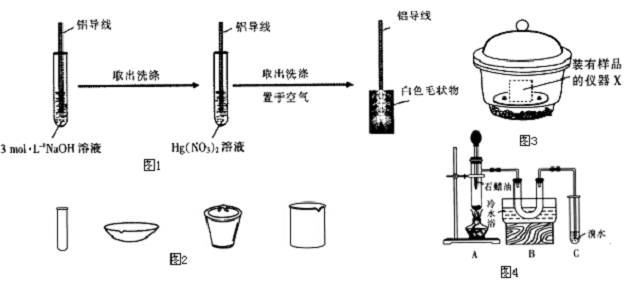
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不锈钢是一种纯净物,它比纯铁的硬度大 | |
| B. | 铝合金是用量最大、用途最广的合金 | |
| C. | 青铜、硬铝和生铁都属于合金 | |
| D. | Na-K合金的熔点介于Na和K单质熔点之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
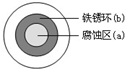
| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-→4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-→Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷的主要成分是碳酸钙 | |
| B. | 用铁容器存放浓盐酸 | |
| C. | 硅是制造半导体的常用材料 | |
| D. | 工业上利用氨气制硝酸属于人工固氮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com