
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
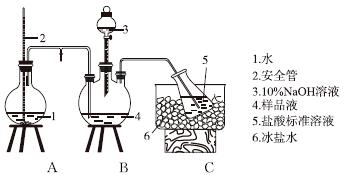
氨的测定装置(已省略加热和夹持装置)
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是__________________________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是____________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO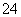 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;X的制备过程中温度不能过高的原因是________。
(1)当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
(2)碱 酚酞(或甲基红)
(3)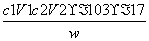 ×100%
×100%
(4)偏低
(5)防止硝酸银见光分解 2.8×10-3
(6)+3 2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
[解析] (1)安全管与大气相通,可通过液体在安全管的上升平衡A瓶内的压强。(2)量取NaOH溶液用碱式滴定管,滴定终点由酸性变到中性,用酚酞作指示剂。(3)根据题给信息可知HCl参与两个反应:氨测定过程中反应为NH3+HCl===NH4Cl,残留HCl与NaOH反应。由氨测定过程中反应的HCl的量可确定氨的量,进而确定氨的质量分数。(4)若气密性不好则会导致氨气逸出,使测量结果偏低。(5)测氯的过程中用硝酸银溶液,而硝酸银见光易分解,故用棕色滴定管;根据溶度积常数和c(Ag+)可计算出c(CrO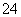 )。(6)由样品中钴、氨、氯的物质的量之比为1∶6∶3得X的化学式[Co(NH3)6]Cl3,利用化合价规则判断钴的化合价;制备X时用到H2O2,而H2O2在温度过高时会分解,且温度过高溶解的氨也会减小。
)。(6)由样品中钴、氨、氯的物质的量之比为1∶6∶3得X的化学式[Co(NH3)6]Cl3,利用化合价规则判断钴的化合价;制备X时用到H2O2,而H2O2在温度过高时会分解,且温度过高溶解的氨也会减小。


科目:高中化学 来源: 题型:
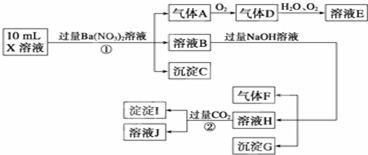 某强酸性溶液X可能含有Ba2+、Al3+、NH
某强酸性溶液X可能含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是___▲___,不能确定是否含有的离子(M)是___▲___,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是__▲____.
(2)写出反应②的离子方程式:___▲___.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式___▲___.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有___▲___.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
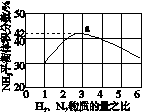

(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应( )
NH3+CO2―→NNNHOOHOH+H2O
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C.属于共价化合物
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是( )
A.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
B.浓硫酸具有强氧化性,常温下可用铝罐盛装
C.氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃
D.过氧化钠具有强氧化性,可用作潜水艇中氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是_______。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是________。
(4)在120 ℃、1.01×105 Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为__________________________________________,反应消耗1 mol NaBH4时转移的电子数目为________。
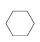 (3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
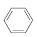 (g)
(g) 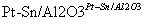 (g)+3H2(g)。
(g)+3H2(g)。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
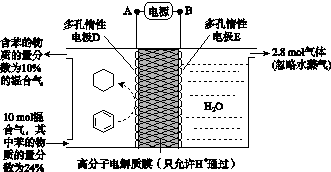
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η=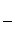 ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com