
分析 (1)根据n=$\frac{m}{M}$知,相同质量的SO2、SO3的物质的量之比等于二者的摩尔质量反比,再结合分子构成计算O原子个数之比;
(2)每个氯化物化学式中含有2个氯离子,所以n(ACl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,M=$\frac{m}{n}$,摩尔质量在数值上等于其相对分子质量,根据A的相对分子质量确定A元素.
解答 解:(1)根据n=$\frac{m}{M}$知,相同质量的SO2、SO3的物质的量之比等于二者的摩尔质量反比=80g/mol:64g/mol=5:4,每个SO2、SO3分子中O原子个数分别是2、3,所以O原子总数之比=(5×2):(4×3)=5:6,
故答案为:5:4;5:6;
(2)每个氯化物化学式中含有2个氯离子,所以n(ACl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,M=$\frac{m}{n}$=$\frac{22.2g}{0.2mol}$=111g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为111,A的相对原子质量=111-35.5×2=40,则A是Ca元素,其化学式为CaCl2,
故答案为:111 g•mol-1;40;CaCl2.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系及分子构成是解本题关键,注意氯化钙中氯离子和氯化钙的关系,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:推断题

 ;
; ,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.
,⑥所需的无机试剂及反应条件是氢氧化钠醇溶液、加热.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
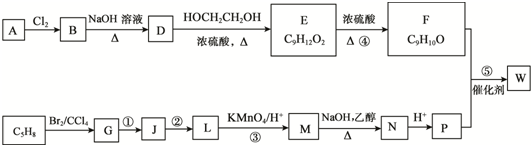
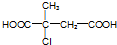 .
. (R1~R4表示烃基)
(R1~R4表示烃基) .
.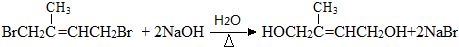 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 | |
| B. | 第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 | |
| C. | 第三周期气态氢化物的沸点均为同主族中沸点最低 | |
| D. | 第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
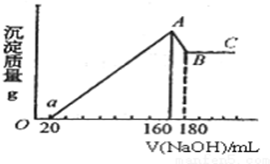 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 若某个化学反应中,反应物的总能量高于生成物的总能量,则该反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2Cl2的结构简式:S-Cl-S-Cl | |
| B. | 13.5g S2Cl2和NaOH反应电子转移数为0.1NA | |
| C. | S2Cl2和NaOH水溶液反应,氧化与还原产物物质的量之比为1:1 | |
| D. | S2Cl2和水反应中,氧化剂还原剂物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2;△H(298K)=-242kJmol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H(298K)=+484kJmol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-242kJmol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H(298K)=-484kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com