
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥⅠA族元素的氢化物中,稳定性最好的沸点也最高 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
分析 A.电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
B.ⅥⅠA族元素,F的非金属性最强,且HF分子间含氢键;
C.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强;
D.非金属性越强,最高价氧化物的水化物酸性增强.
解答 解:A.电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,则第三周期元素的金属离子半径从左到右逐渐减小,铝离子半径最小,阴离子半径逐渐减小,故A错误;
B.ⅥⅠA族元素,F的非金属性最强,且HF分子间含氢键,则HF的稳定性最好的沸点也最高,故B正确;
C.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,不是同周期不一定,如Ca的金属性大于Na,故C错误;
D.非金属性越强,最高价氧化物的水化物酸性增强,则同周期非金属元素最高价氧化物对应水化物的酸性从左到右依次增强,故D错误;
故选C.
点评 本题考查元素周期表及周期律的综合应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+3)}{A+3}$mol | B. | $\frac{a(A-N+8)}{A+16}$mol | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$mol | D. | $\frac{2A-2N+24}{2A+54}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的消耗速率等于NO的消耗速率 | |
| B. | 容器内始终有N2、O2和NO共存 | |
| C. | 容器内反应混合物的总物质的量不随时间改变 | |
| D. | V正(N2)=V逆(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
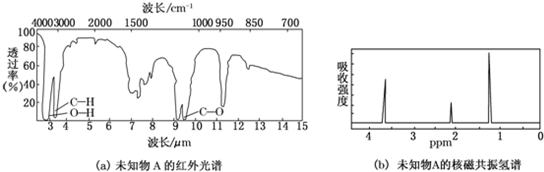
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,HAt极不稳定 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
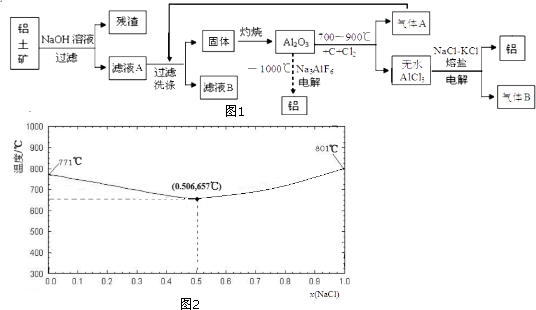
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com