
| A. | 物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,硫酸氢铵中的铵根离子物质的量浓度较小 | |
| B. | 在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)<Ksp(AgCl) | |
| C. | 物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后:c(X-)+c(HX)=0.02 mol/L | |
| D. | 己知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含C1-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀 |
分析 A.硫酸氢铵溶液中电离出氢离子抑制铵根离子的水解,醋酸铵溶液中醋酸根离子水解促进铵根离子的水解;
B.氯化银白色沉淀加入硫化钠溶液中生成黑色沉淀,说明硫化银溶解度小于氯化银,阴阳离子比不同不能比较溶度积常数;
C.溶液中存在物料守恒分析;
D.析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.1}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\frac{(\;\;\;\;)}{(\;\;\;\;)}$$\sqrt{\frac{9.0×1{0}^{-12}}{0.1}}$mol/L,c(Ag+)越小,先生成沉淀;
解答 解:A.硫酸氢铵溶液中电离出氢离子抑制铵根离子的水解,醋酸铵溶液中醋酸根离子水解促进铵根离子的水解,物质的量浓度相同的硫酸氢铵溶液和醋酸铵溶液中,醋酸铵中的铵根离子物质的量浓度较小,故A错误;
B.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明硫化银溶解度小于氯化银,阴阳离子比不同不能比较溶度积常数,故B错误;
C.物质的量浓度均为0.02 mol/L的弱酸HX及其盐NaX等体积混合后,溶液中存在物料守恒:c(X-)+c(HX)=0.02 mol/L,故C正确;
D.析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.1}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\frac{(\;\;\;\;)}{(\;\;\;\;)}$$\sqrt{\frac{9.0×1{0}^{-12}}{0.1}}$mol/L,c(Ag+)越小,先生成沉淀,故AgCl先出现沉淀,故D错误;
故选C.
点评 本题考查了盐类水解原理、溶度积常数比较和计算、电解质溶液中物料守恒的分析判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
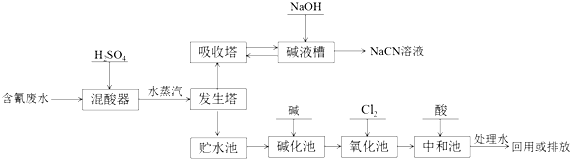
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; .
.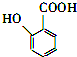 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是 .
.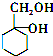 的合成路线流程图(自选无机试剂).合成路线流程图示例:
的合成路线流程图(自选无机试剂).合成路线流程图示例:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| C. | 向该混合溶液中加入适量H2O2,并调节pH到3~4后过滤可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 16.8g | C. | 22.4g | D. | 33.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2和NO或NO2中的至少一种 | B. | 肯定只有NO | ||
| C. | 可能有Cl2和O2 | D. | 肯定没有Cl2、O2和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,减小压强,A的转化率增大 | |
| B. | 升高温度,减小体积,有利于平衡向正反应方向移动 | |
| C. | 增大A的浓度,平衡正向移动,A的转化率增大 | |
| D. | 降低温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com