
| A. | CH4O和C2H6O | B. | C2H4和C6H12 | C. | C2H2和C4H6 | D. | CH4和C3H8 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量氧气中完全燃烧转移的电子数为2NA | |
| D. | 28g N2中含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 价电子排布为4s24p2的元素位于第四周期第ⅤA族,是P区元素 | |
| B. | 1,2-二甲苯核磁共振氢谱中有三组峰,且氢原子数之比为3:1:1 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 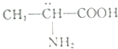 分子属于手性分子 分子属于手性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 稀硫酸滴入碳酸钠溶液中,将产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中产生白色胶状沉淀 | 非金属性:S>C>Si |
| B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 将饱和氯化铁溶液滴入盛有沸水的烧杯中,继续煮沸至溶液呈红褐色,停止加热,用激光笔照射烧杯中的液体 | 看到一条光亮的“通路” | 证明生成了氢氧化铁沉淀 |
| D | 在分液漏斗中加入碘水后再加入CCl4,充分振荡、静置 | 分层,且上层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.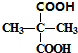 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. 与足量NaOH水溶液反应的化学方程式为
与足量NaOH水溶液反应的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量一定低于生成物的总能量 | |
| B. | 所有的中和反应都为放热反应 | |
| C. | 破坏反应物中的化学键所吸收的总能量大于形成生成物中化学键所放出的总能量 | |
| D. | 放热反应,不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.
氧化-还原反应是中学化学中一类重要的反应类型,在日常生活中很常见,请回答:(1)在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中.当产生标况下4.48L气体时,消耗单质铜19.2g,此时转移了0.6mol电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com