
| A.用25ml量筒量取12.36 ml 盐酸 |
| B.用托盘天平称取8.75克食盐 |
| C.用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml |
| D.用pH试纸测得某溶液的PH为3.5 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源:不详 题型:实验题
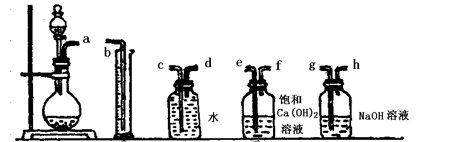
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用图1所示装置分离有机层和水层 |
| B.用图2所示装置从食盐水中提取NaCl |
| C.用图3所示装置用水来吸收HCl |
| D.用图4所示装置收集并检验氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅酸钠溶液和碱性溶液存放在胶塞密封的试剂瓶中 |
| B.氢氟酸盛放在棕色试剂瓶中 |
| C.液溴盛放在带有胶塞的细口瓶中 |
| D.氯水盛放在棕色细口瓶中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
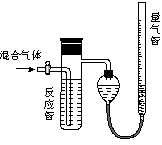
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用比室温约高10~20℃的水溶解明矾晶体得到饱和溶液 |
| B.使明矾饱和溶液急速冷却 |
| C.选用形状较为规则的小明矾晶体作晶核 |
| D.结晶过程中,应将硬纸板盖住盛有饱和溶液的烧杯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②③ | C.①②④ | D.②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com