
| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
分析 若NaHY为强酸的酸式盐,则溶液显酸性,在溶液中完全电离;
若NaHY为弱酸的酸式盐,在溶液中存在电离平衡和水解平衡,结合水解平衡和电离平衡程度的相对大小分析.
解答 解:A.若NaHY为弱酸的酸式盐,而且在溶液中水解平衡程度大于电离平衡程度,则溶液显碱性,故A错误;
B.若NaHY为强酸的酸式盐,则溶液显酸性,在溶液中完全电离,Y2-不水解,不存在Y2-+H2O?OH-+HY-,故B错误;
C.若显酸性,溶液加水稀释,酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,若显碱性,加水稀释,氢氧根离子浓度减小,氢离子浓度增大,故C错误;
D.若NaHY为强酸的酸式盐,则c(Na+)=c(Y2-),若为弱酸的酸式盐,则c(Na+)>c(Y2-),所以溶液中:c(Na+)≥c(Y2-),故D正确.
故选D.
点评 本题考查了弱电解质的电离和盐的水解,该题分两种情况强酸的酸式盐和弱酸的酸式盐分析,侧重于学生的分析能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
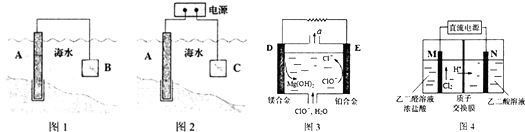
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
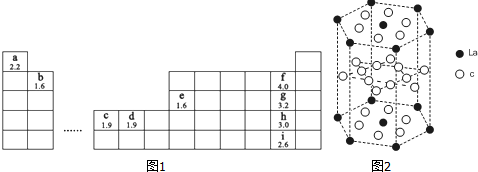
 .
.| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
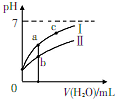 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 向NaCl0溶液中通人少量二氧化碳的离子方程式为:2C1O-+CO2+H2O=2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | a、b、c三点所示溶液中水的电离程度:c>a>b | |
| D. | 图象中,I表示CH3COOH,Ⅱ表示HC1O,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 | |
| B. | Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | Na、K合金具有强还原性,可用于原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 冰箱中使用的含氟制冷剂泄漏后,会增加空气中PM 2.5的含量 | |
| C. | 氯气和活性炭均可作为漂白剂,同时使用可增强漂白效果 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com