
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:
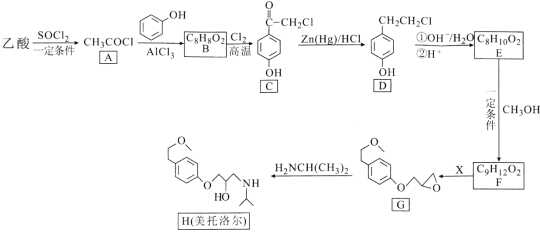
回答下列问题:
(1)写出C中能在NaOH溶液里发生反应的官能团的名称______。
(2)A→B和C→D的反应类型分别是___________、____________,H的分子式为______。
(3)反应E→F的化学方程式为______。
(4)试剂X的分子式为C3H5OCl,则X的结构简式为______。
(5)B的同分异构体中,写出符合以下条件:①含有苯环;②能发生银镜反应;③苯环上只有一个取代基且能发生水解反应的有机物的结构简式____________。
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:____________(无机试剂任用)。
)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:____________(无机试剂任用)。
【答案】(酚)羟基 ; 氯原子 取代反应 还原反应 C15H25O3N ![]() +CH3OH
+CH3OH![]() +H2O
+H2O ![]()
![]()

【解析】
由B的分子式、C的结构,可知B与氯气发生取代反应生成C,故B为 ,C发生还原反应生成D为
,C发生还原反应生成D为![]() .对比D、E的分子式,结合反应条件,可知D中氯原子水解、酸化得到E为
.对比D、E的分子式,结合反应条件,可知D中氯原子水解、酸化得到E为![]() .由G的结构可知,E中醇羟基与甲醇发生分子间脱水反应生成F,F中酚羟基上H原子被取代生成G,故F为
.由G的结构可知,E中醇羟基与甲醇发生分子间脱水反应生成F,F中酚羟基上H原子被取代生成G,故F为![]() .对比G、美托洛尔的结构可知,G发生开环加成生成美托洛尔。
.对比G、美托洛尔的结构可知,G发生开环加成生成美托洛尔。
(1) 由结构可知C中官能团为:(酚)羟基、羰基和氯原子,在氢氧化钠溶液中,由于和氯元素相邻的碳原子上没有氢原子,不能发生消去反应,羰基不与氢氧化钠反应,酚羟基有弱酸性,可以与氢氧化钠反应;
(2) B为 ,根据流程图中A和B的结构式分析,A中的氯原子将苯酚上的氢原子取代得到B,则为取代反应;D为
,根据流程图中A和B的结构式分析,A中的氯原子将苯酚上的氢原子取代得到B,则为取代反应;D为![]() ,根据分析,C发生还原反应生成D;根据流程图中美托洛尔的结构简式,每个节点为碳原子,每个碳原子形成4个共价键,不足键用氢原子补充,则H的分子式为C15H25O3N;
,根据分析,C发生还原反应生成D;根据流程图中美托洛尔的结构简式,每个节点为碳原子,每个碳原子形成4个共价键,不足键用氢原子补充,则H的分子式为C15H25O3N;
(3) E中醇羟基与甲醇发生分子间脱水反应生成F,化学方程式为:![]() +CH3OH
+CH3OH![]() +H2O;
+H2O;
(4) F为![]() ,F中酚羟基上H原子被取代生成G,对比二者结构可知,X的结构简式为
,F中酚羟基上H原子被取代生成G,对比二者结构可知,X的结构简式为![]() ;
;
(5) B为 ,B的同分异构体中,含有苯环;能发生银镜反应,说明含有醛基;苯环上只有一个取代基且能发生水解反应,故有机物的结构简式
,B的同分异构体中,含有苯环;能发生银镜反应,说明含有醛基;苯环上只有一个取代基且能发生水解反应,故有机物的结构简式![]() ;
;
(6)苯甲醇发生氧化反应生成苯甲醛,苯甲醛与苯酚反应生成 ,最后与Zn(Hg)/HCl作用得到目标物。合成路线流程图为:
,最后与Zn(Hg)/HCl作用得到目标物。合成路线流程图为: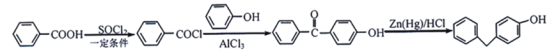 。
。


科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
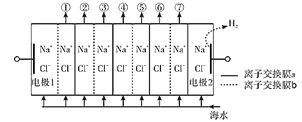
A.离子交换膜a为阴离子交换膜
B.通电时,电极2附近溶液的pH增大
C.淡化过程中,得到的浓缩海水没有任何使用价值
D.各间隔室的排出液中,②④⑥为淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)![]() Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
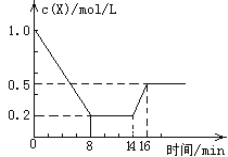
A. 0~8min用Y表示的该反应的速率为0.1mol·L-1·min-1
B. 8min时达到平衡,该反应的平衡常数为K=0.5
C. 14min时,改变的反应条件是降低了体系的温度
D. 16min时的正反应速率,比8min时的正反应速率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应![]() 的
的![]() ,
,![]() 、
、![]() 分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
(2)对于一般的化学反应aA+bB→P,反应物浓度和反应速率之间存在以下关系: v(单位mol·L-1·min-1)=k×c(A)x ×c(B)y,k称为速率常数,x称为反应物A的级数,y称为反应物B的级数,x+y称为反应的总级数。
① 对于反应H2(g)+I2(g)→2HI(g),速率表达式:v=k×c(H2)×c(I2),则反应总级数为________级。
② H2O2分解成水和氧气的反应是一级反应,反应速率常数k为0.0410 min-1,则过氧化氢分解一半的时间是__________min。(结果保留3位有效数字)(已知:一级反应物质浓度c=c0e-kt,c0为初始浓度,ln2=0.693)
(3)将等物质的量的I2和H2置于预先抽真空的特制1L密闭容器中,加热到1500 K,起始总压强为416kPa;体系达平衡,总压强为456kPa。体系中存在如下反应关系:
①I2(g)2I(g) Kp1 = 200 ΔH1
②I2(g)+ H2(g)2HI(g) Kp2 ΔH2
③HI(g)I(g)+ H(g) Kp3 ΔH3
④H2(g)2H(g) Kp4 ΔH4
(已知Kp3、 Kp4值很小,③、④反应忽略;Kp为以分压表示的平衡常数,以下计算结果均保留2位有效数字)
①ΔH2=_____________。(用含ΔH1、ΔH3、ΔH4的式子表示)
②1500K平衡体系中I(g)、H2(g)分压分别为______kPa、_______kPa、Kp2=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )
A.将![]() 的
的![]() 溶液与
溶液与![]() 溶液充分混合,若混合后溶液的体积为10mL,则混合液的
溶液充分混合,若混合后溶液的体积为10mL,则混合液的![]()
B.将![]() 的某一元酸HA溶液和
的某一元酸HA溶液和![]() 溶液等体积混合,混合液pH大于7,则反应后的混合液中:
溶液等体积混合,混合液pH大于7,则反应后的混合液中:![]()
C.pH相等的![]()
![]()
![]() 溶液中,
溶液中,![]() 大小关系:
大小关系:![]()
D.常温下,![]() 的
的![]() 和NaClO的混合溶液中:
和NaClO的混合溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法不正确的是( )
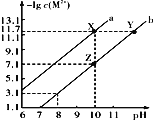
A. Ksp[Cu(OH)2]的数量级为10-20
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
C. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D. 向Z点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________(填化学式)
②根据实验(ii)的现象_______(填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。
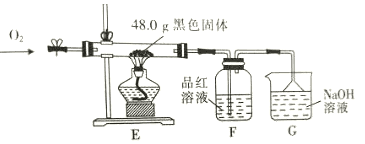
实验序号 | 反应前黑色固体质量/g | 充分反应后黑色固体质量/g |
I | 48.0 | 48.0 |
Ⅱ | 48.0 | 44.0 |
Ⅲ | 48.0 | 40.0 |
根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________;实验Ⅱ中黑色固体的成分及质量为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
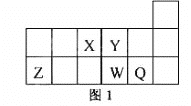
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com