
| 除杂试剂 | 离子方程式 | 操作 | |
| (1)BaCl2(HCl) | 过量 |
过滤 | |
| (2)Cu(Zn) | |||
| (3)SiO2(Al2O3) | |||
| (4)CO(CO2) |
| 除杂试剂 | 离子方程式 | 操作 | |
| (1)BaCl2(HCl) | 稀盐酸 | BaCO3+2H+═Ba2++CO2↑+H2O | |
| (2)Cu(Zn) | 过量稀盐酸 | Zn+2H+=Zn 2++H2↑ | 过滤 |
| (3)SiO2(Al2O3) | 过量稀盐酸 | Al2O3+6H+=2Al3++3H2O | 过滤 |
| (4)CO(CO2) | 足量NaOH溶液 | CO2+2OH-=CO32-+H2O | 洗气 |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
| A、钠与水反应 Na+H2O=Na++OH-+H2↑ |
| B、澄清石灰水中通入足量CO2 Ca2++2OH-+CO2=CaCO3↓+H2O |
| C、NaCl溶液中加入AgNO3溶液 Cl-+Ag+=AgCl↓ |
| D、NaBr溶液中通入氯气 Br-+Cl2=Br2+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
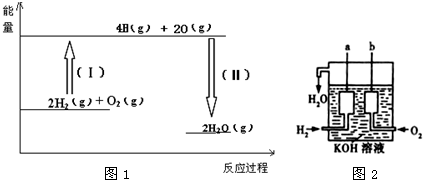
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
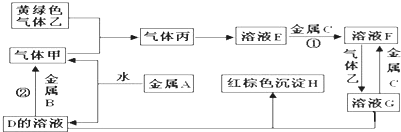
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子序数 | 电子排布式 | 在周期表中的位置 | 最高价氧化物的水化物化学式及酸碱性 | 气态氢化物的化学式 |
| 14 | ||||
| 1s22s22p63s23p5 | ||||
| 第二周期第VA主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com