
【题目】下列物质不属于氧化物的是 ( )
A.MgO B.HClO C.Cu2O D.ClO2
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__________。
(2)为提高水浸速率,可采取的措施为_________(任写一条)。“浸渣”的主要成分为________。
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是_________(填字母代号)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为________________。
(5)流程中可以循环利用的物质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁一次氯酸钠热料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是

A. 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2
B. 图乙中惰性电极棒上有02放出
C. 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
D. 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
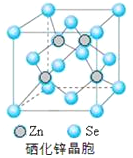
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为____________。
(2)锗、砷、硒的第一电离能大小排序为____________。H2SeO4的酸性比H2SeO3的强,其原因是__________。
(3)H2SeO3的中心原子杂化类型是_______;SeO32-的立体构型________。
(4)H2Se属于____________ (填“极性”或“非极性”)分子;单质Se的熔点为217℃,它属于_________晶体。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_________;若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg/mol。NA代表阿伏加德罗常数,则晶胞参数a为__________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从宏观现象探究微观本质是重要的化学学科素养。以FeCl3溶液为实验研究对象,探究其与碱性物质之间的复杂多样性。实验如下:
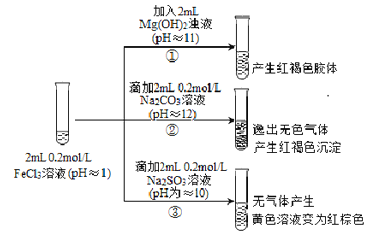
(1)①中反应的离子方程式是_________________。
(2)②中逸出的无色气体是_______________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀。 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是______________。
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的。其实验方案是取Ⅰ中所得溶液少许进行__________离子的检验。
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液。溶液变无色 |
⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅰ.⑤的实验目的是___________。
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:
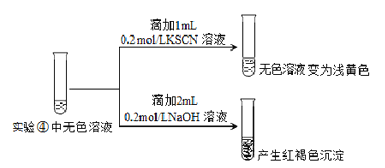
资料显示:FeF3溶液为无色。
用平衡移动原理解释红褐色沉淀产生的原因:_______________。
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与_____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
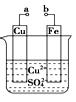
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-==Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:N2(g)+3H2(g) ![]() 2NH3(g)。反应从正反应开始。下列说法错误的是
2NH3(g)。反应从正反应开始。下列说法错误的是
A. 反应开始时,正反应速率最大 B. 反应开始时,v逆(NH3)=0
C. v(H2)∶v(NH3)=3∶2时,反应达到平衡状态 D. 单位时间内,消耗n mol N2的同时生成3n mol H2 ,此时该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家及其提出学说与贡献的叙述不对应的是( )
A. 道尔顿提出原子学说
B. 汤姆生发现电子,并提出原子结构轨道模型
C. 舍勒发现了氯气
D. 卢瑟福根据α粒子散射现象,提出了带核的原子结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是
A. ①③ B. ③④ C. ①② D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com