
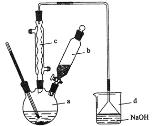
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
【答案】![]() +Br2
+Br2 ![]() +HBr 吸收HBr(Br2),并能防倒吸 冷凝、回流、(导气) C 分液漏斗 除去溶解的Br2(HBr) C
+HBr 吸收HBr(Br2),并能防倒吸 冷凝、回流、(导气) C 分液漏斗 除去溶解的Br2(HBr) C
【解析】
(1)苯与液溴在溴化铁的作用下发生反应生成溴苯和溴化氢;溴化氢易溶于水,则装置的作用为吸收HBr(Br2),并能防倒吸;
(2)①装置c为球形冷凝管,反应为放热反应,可导致溴挥发;
②溴的沸点为59℃,为减少溴的损失,应控制温度小于59℃;
(3)生成的溴苯、未反应的苯、溴均不溶于水,分离水层与油状物质用分液漏斗分离;溴可与NaOH反应生成溴化钠、次溴酸钠和水,除去溶解的Br2和HBr;
(4)苯与溴苯为相互溶解的液体,其沸点差距较大,可用蒸馏的方法分离。
(1)苯与液溴在溴化铁的作用下发生反应生成溴苯和溴化氢,方程式为![]() +Br2
+Br2 ![]() +HBr;溴化氢易溶于水,则装置的作用为吸收HBr(Br2),并能防倒吸;
+HBr;溴化氢易溶于水,则装置的作用为吸收HBr(Br2),并能防倒吸;
(2)①装置c为球形冷凝管,反应为放热反应,可导致溴挥发,而装置c可使溴蒸气冷凝、回流,也可使生成的HBr气体流出;
②溴的沸点为59℃,为减少溴的损失,应控制温度小于59℃,答案为C;
(3)生成的溴苯、未反应的苯、溴均不溶于水,分离水层与油状物质用分液漏斗分离;溴可与NaOH反应生成溴化钠、次溴酸钠和水,除去溶解的Br2和HBr;
(4)苯与溴苯为相互溶解的液体,其沸点差距较大,可用蒸馏的方法分离,答案为C。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】由于石油资源有限,且汽油燃烧会产生严重的污染,未来将用氢气作为燃料来取代汽油,生产21世纪环保汽车。已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1;H2O(l)=H2O(g) ΔH=+44kJ·mol-1
(1)写出氢气和氧气反应生成液态水的热化学方程式:____。
(2)若要得到857.4kJ的热量,至少需氢气的质量为____,这些氢气在标准状况下的体积为____。
(3)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH
CO2(g)+4H2(g) ΔH
反应过程中能量变化如图所示,则该反应为反应____(填“吸热”或“放热”)

若已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
则该反应的ΔH为_____(用含a、b、c、d字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )
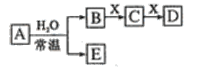
A.若D为CO,C能和E反应,则A一定为![]() ,其电子式
,其电子式![]()
B.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
C.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E一定能还原Fe2O3
D.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向![]() 溶液中,逐渐加入铁粉至过量
溶液中,逐渐加入铁粉至过量![]() 假设生成的气体只有一种
假设生成的气体只有一种![]() ,在此过程中,
,在此过程中,![]() 随
随![]() 变化如图所示,试回答下列问题:
变化如图所示,试回答下列问题:
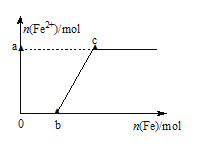
(1)写出![]() 段的离子方程式:_______________。
段的离子方程式:_______________。
(2)a=__________,![]() ___________;
___________;
(3)写出向c点处的反应液中加入稀盐酸后的离子方程式:________________。
(4)当加入铁粉nmol时![]() ,溶液中Fe
,溶液中Fe![]() 的物质的量为_____________
的物质的量为_____________![]() 用含n的式子表示
用含n的式子表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种成几种,取该溶液进行实验,实验内容和相关数据
中的一种成几种,取该溶液进行实验,实验内容和相关数据![]() 气体体积在标准状况下测定
气体体积在标准状况下测定![]() 如下:
如下:

![]() 溶液中一定不存在的离子是______。
溶液中一定不存在的离子是______。
![]() 已知气体D为NO,加入过量
已知气体D为NO,加入过量![]() 和
和![]() 溶液时,发生反应的离子方程式为______。
溶液时,发生反应的离子方程式为______。
![]() 溶液中
溶液中![]() ______
______![]() ,
,![]() ______
______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其他七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常作为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。
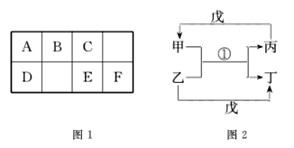
已知图2中反应①是复分解反应,生成物中水已略去。请回答下列问题:
(1)上述元素组成的单质中,硬度最大的是_________________(填该物质名称)。
(2)若戊是含有18电子的双原子分子,则丙的电子式为________________;在①中制取气体丙的化学方程式为_______________________________________________ 。
(3)若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用作干燥剂,写出甲的一种用途:_____________________________。
(4)如果图2中反应①是置换反应,戊是单质,则戊不可能是 _____________。(填序母序号)
A、O2 B、Cl2 C、H2 D、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
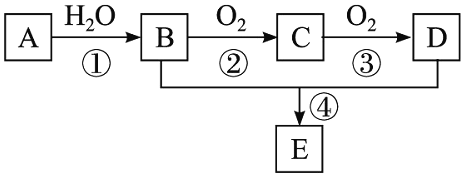
请回答下列问题:
![]() 写出A的结构简式______。
写出A的结构简式______。
![]() 、D分子中的官能团名称分别是______、______。
、D分子中的官能团名称分别是______、______。
![]() 物质B可以被直接氧化为D,需要加入的试剂是______。
物质B可以被直接氧化为D,需要加入的试剂是______。
![]() 写出下列反应的化学方程式及其反应类型。
写出下列反应的化学方程式及其反应类型。
![]() ______;反应类型:______。
______;反应类型:______。
![]() ______;反应类型:______。
______;反应类型:______。
![]() ______;反应类型:______。
______;反应类型:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是多种高级脂肪酸的甘油酯。油脂的下列性质和用途中,与其含有不饱和的碳碳双键有关的是( )
A.油脂是产生能量最高的营养物质
B.利用油脂在碱性条件下的水解,可以制甘油和肥皂
C.植物油通过氢化(加氢)可以变为脂肪
D.脂肪是有机体组织里储存能量的重要物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物丙可由有机物甲和乙在一定条件下反应制得:
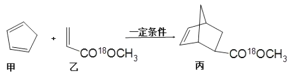
下列说法正确的是
A.丙在碱性条件下水解生成 和CH318OH
和CH318OH
B.甲分子中所有原子共平面
C.乙的化学式是C4H518OO
D.甲与乙生成丙的反应属于加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com