
【题目】“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液.某研究小组用该含碘废液制备NaI固体,实验流程如下:
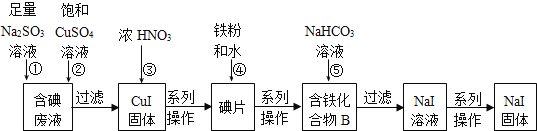
已知:反应②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列问题:
(1)产生含碘废液的离子方程式为____________。
(2)①中I2与Na2SO3溶液反应的离子方程式为_________。
(3)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为______。
【答案】Cl2+2I-═I2+2Cl- I2+SO32-+H2O═SO42-+2I-+2H+ Fe3I8 Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O
【解析】
根据流程中的反应②发生反应:2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+,过滤则得到碘化亚铜沉淀,碘化亚铜可以被硝酸氧化为碘单质,碘单质中加入铁和水,会得到化合物B,是一种含有铁元素和碘元素的化合物,再向其中加入碳酸氢钠溶液,过滤可以得到碘化钠的溶液,从而制得碘化钠固体;
(1)将少量氯水加入到NaI溶液中,氯气能将碘单质置换出来;
(2)碘单质具有氧化性,亚硫酸根离子具有还原性,I2与Na2SO3溶液发生氧化还原反应;
(3)根据物质中元素的物质的量之比等于原子个数之比来回答;
(4)向碘化铁的溶液中加入碳酸氢钠溶液则生成黑色固体四氧化三铁和二氧化碳无色气体。
(1)将少量氯水加入到NaI溶液中,氯气能将碘单质置换出来,发生的反应为:Cl2+2I-═I2+2Cl-;
(2)碘单质具有氧化性,亚硫酸根离子具有还原性,I2与Na2SO3溶液发生氧化还原反应,即I2+SO32-+H2O═SO42-+2I-+2H+;
(3)化合物B,是一种含有铁元素和碘元素的化合物,铁元素与碘元素物质的量之比为3:8,则化合物B的化学式为Fe3I8;
(4)向碘化铁的溶液中加入碳酸氢钠溶液则生成黑色固体四氧化三铁和二氧化碳无色气体,发生的反应为:Fe3I8+8NaHCO3═Fe3O4+8NaI+8CO2↑+4H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有重要应用。
(1)氨的催化氧化是工业生产硝酸的基础,写出该化学方程式_________。
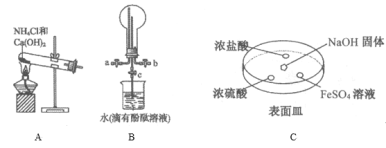
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:
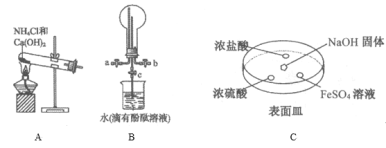
①用装置B收集氨时,氨的进气口是__(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,______。
②向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现 _____,(填现象)发生反应的化学方程式为_______。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_________。
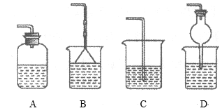
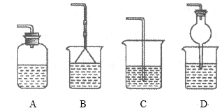
③为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的__(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
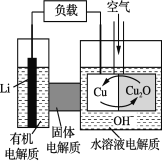
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在工农业生产中有重要应用。
(1)氨的催化氧化是工业生产硝酸的基础,写出该化学方程式_________。
(2)某化学实验小组同学利用以下装置制备氨,并探究氨的性质(部分仪器已略去)。
请回答:
①用装置B收集氨时,氨的进气口是__(选填“a”或“b”)。打开装置B中的活塞c,若观察到烧瓶内产生了红色喷泉,则说明氨具有的性质是______,______。
②向C中NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。浓盐酸液滴附近会出现 _____,(填现象)发生反应的化学方程式为_______。FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O===Fe(OH)2↓+2NH4+和_________。
③为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨的__(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组学习了亚铁盐的性质后,欲探究FeSO4溶液分别与Na2CO3溶液、NaHCO3溶液的反应。已知:Fe(OH)2和FeCO3均为白色沉淀,不存在Fe(HCO3)2。实验操作及现象记录如下:
实验 | 试剂 | 操作及现象 | ||
试管(I) | 试管(II) | |||
(试管容积为50 mL) | 实验a | 1.0 mol·L-1 FeSO4溶液 24 mL | 1.0 mol·L-1 Na2CO3溶液24mL | 倾倒完后,迅速用胶塞塞紧试管I的口部,反复上下颠倒摇匀,使反应物充分混合 反应过程中无气泡产生,生成白色絮状沉淀 放置1.5~2 h后,白色絮状沉淀转化为白色颗粒状沉淀 |
实验b | 1.0 mol·L-1 FeSO4溶液 10 mL | 1.0 mol·L-1 NaHCO3溶液 20 mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4 min后液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色 | |
(1)甲同学认为实验a中白色颗粒状沉淀是FeCO3,写出该反应的离子方程式:________;他为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入________,发现产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有Fe(OH)2,他将实验a中两种溶液体积均改成15 mL后再进行实验,证实了他的推测。能证明Fe(OH)2存在的实验现象是_________。
(3)实验b中白色颗粒状沉淀主要成分也为FeCO3,写出生成FeCO3的离子方程式:________。
(4)实验b中液面上方试管内壁粘附的白色颗粒状沉淀物变成红褐色,主要原因是潮湿的FeCO3被氧气氧化,写出该反应的化学方程式:__________。
(5)乙同学反思,实验a中含有Fe(OH)2,实验b中几乎不含有Fe(OH)2,对比分析出现差异的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像的描述中,正确的是( )

A. 根据图①可判断正反应的ΔH<0
B. 根据图②,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
C. 图③可表示压强(p)对反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D. 图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据阿伏伽德罗常数回答下列问题
(1)在0.5mol CO2中含___个O原子,含___个e-。
(2)同温同压下,同质量的氨气和硫化氢气体体积比为____,其中含有的氢原子数目比为____。
(3)___mol H2SO4分子与1.806×1024个H2O分子含有相同的氧原子数?
(4)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为___,R的相对原子质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 molNaHCO3与足量盐酸反应放出CO2气体的体积为22.4L
B.1 mol Al3+离子含有的核外电子数为3NA
C.7.8g过氧化钠与足量水反应,转移电子数为0.1NA
D.O2和O3的混合气体,质量为48g,所含氧原子数为1.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com