
氨气是一种重要的化工原料,主要用于生产氮肥、硝酸、纯碱等化工产品。下图是合成氨,并联合生产硝酸、纯碱的简要流程示意图:
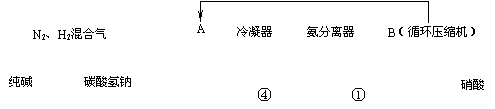 |
(1)设备A的名称是 ,设置循环B→A的目的是 。
(2)反应①的化学方程式是 。
反应③中氧化剂和还原剂的质量比为 。
(3)用两个化学方程式表示过程⑤中的反应过程。
(4)上述纯碱生产中过程⑤CO2的主要来源是 。
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:阅读理解
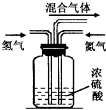 氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体.
| ||
| ||
| C2(NH3)?C(CO2) |
| C(H2O) |
| C2(NH3)?C(CO2) |
| C(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
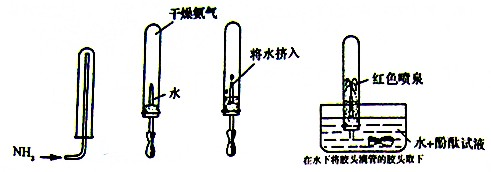
查看答案和解析>>
科目:高中化学 来源: 题型:
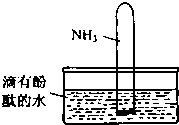 氨气是一种重要的化工原料.完成下列填空:
氨气是一种重要的化工原料.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
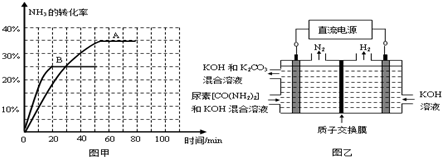
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com