
【题目】(题文)如图是元素周期表的一部分,回答下列问题: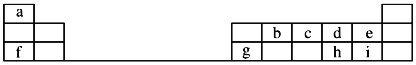
![]() 元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______
元素e的负一价离子的结构示意图为 ______ ,f、g、h、i对应简单离子的半径由大到小的顺序为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
![]() 元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为 ______ .
![]() 、c、d三种原子的第一电离能大小顺为 ______
、c、d三种原子的第一电离能大小顺为 ______ ![]() 用具体微粒符号表示
用具体微粒符号表示![]() .
.
【答案】 ![]()
![]()
![]()
![]()
【解析】
根据元素周期表的结构推知,a、b、c、d、e、f、g、h、i依次为H、C、N、O、F、Na、Al、S、Cl元素;根据元素周期律和相关化学用语作答。
根据元素周期表的结构推知,a、b、c、d、e、f、g、h、i依次为H、C、N、O、F、Na、Al、S、Cl元素。
(1)e为F元素,F-的核电荷数为9,核外有10个电子,F-的离子结构示意图为![]() 。f、g、h、i对应简单的离子分别为Na+、Al3+、S2-、Cl-,根据“层多径大、序大径小”,四种简单离子半径由大到小的顺序为S2-
。f、g、h、i对应简单的离子分别为Na+、Al3+、S2-、Cl-,根据“层多径大、序大径小”,四种简单离子半径由大到小的顺序为S2-![]() Cl-
Cl-![]() Na+
Na+![]() Al3+。
Al3+。
(2)元素i的单质为Cl2,Cl2与水反应生成HCl和HClO,其中具有漂白作用的化合物是HClO,HClO的电子式为![]() 。
。
(3)b、c、d依次为C、N、O,根据同周期从左到右元素的第一电离能呈增大趋势,N的2p处于半充满较稳定,C、N、O的第一电离能由大到小的顺序为N![]() O
O![]() C。
C。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】氯仿![]() 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() ,下列说法不正确的有
,下列说法不正确的有![]()
![]()

A. ![]() 分子为含极性键的非极性分子
分子为含极性键的非极性分子
B. ![]() 分子中含有3个
分子中含有3个![]() 键、一个
键、一个![]() 键,中心C原子采用
键,中心C原子采用![]() 杂化
杂化
C. ![]() 分子中所有原子的最外层电子都满足8电子稳定结构
分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)石墨中化学键类型为______________,在电池中的作用为_________________
(2) 酸性锌锰干电池的负极反应为_________________________
(3) 碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式_____________
(4)填充物用60℃温水溶解,目的是_____________________。
(5)操作A的名称为______________。
(6)铜帽溶解时加入H2O2的目的是_______________________(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识解答问题:
![]() 在高温下CuO能分解生成
在高温下CuO能分解生成![]() ,试从原子结构角度解释其原因: ______
,试从原子结构角度解释其原因: ______ ![]() 根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 ______ 区
根据元素原子的外围电子排布特征,可将周期表分成五个区域,元素Cu属于 ______ 区![]()
![]() 氰酸
氰酸![]() 是一种链状分子,它与异氰酸
是一种链状分子,它与异氰酸![]() 互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ______
互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ______ ![]() 其中的C的杂化类型为 ______ .
其中的C的杂化类型为 ______ .
![]() 原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物
原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物![]() 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ______ .
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ______ .
![]() 立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 ______ 个氮原子, ______ 个硼原子,设氮原子半径为apm,硼的原子半径bpm,求该晶胞的空间利用率 ______
立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其晶胞结构与金刚石类似,一个该晶胞中含有 ______ 个氮原子, ______ 个硼原子,设氮原子半径为apm,硼的原子半径bpm,求该晶胞的空间利用率 ______ ![]() 用含a、b的代数式表示
用含a、b的代数式表示![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的说法中,正确的是( )
A. 热稳定性:Na2CO3<NaHCO3
B. Na2CO3和NaHCO3均可与澄清石灰水反应
C. 相同温度下,在水中Na2CO3的溶解度小于NaHCO3
D. 106 g Na2CO3和84 g NaHCO3分别与过量盐酸反应,放出CO2的质量:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因创造性地研制出抗疟新药青蒿素和双氢青蒿素(对疟原虫有100%的抑制率)而获2015年诺贝尔医学奖。如图为青蒿素的键线式,以下关于青蒿素的说法错误的是
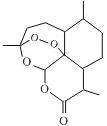
A. 含有酯基,可水解
B. 含有过氧键,有较强氧化性,且不够稳定
C. 青蒿素的化学式C15 H24O5
D. 在水中溶解度不大,易溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com