
磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品。已知:1mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3mol、2mol、1mol。下列推断正确的是
A.磷酸与氢氧化钠反应能生成2种盐
B.NaH2PO4、NaH2PO3、NaH2PO2都是酸式盐
C.H3PO4、H3PO3、H3PO2都是含氧酸
D.H3PO3是三元酸,又是还原性酸
科目:高中化学 来源:2016-2017学年河北省高一上学期第一次月考化学试卷(解析版) 题型:选择题
在除杂过程中要尽量除去杂质,那么,加入的试剂必须稍过量,且最后过量物质可以使用物理方法或化学方法除去。现要除 去NaCl中少量的CaCl2、Na2SO4杂质,下列选用试剂及使用顺序正确的是( )
A.Na2CO3、BaCl2、HCl B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl D.Ba(NO3)2、Na2CO3、HCl
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列实验能达到相应目的的是
A.用Zn与浓硫酸反应可获得高浓度SO2
B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
C.选择相同的气体发生装置分别用Na2O2、CaCO3制备O2、CO2
D.可用分液的方法分离碘和酒精
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:填空题
有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是_________和_________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时,产生蓝色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,剩余白色固体,则X为 (填序号)。
A.Br- B.SO42- C.CH3COO- D.HCO3-
(3)将19.2gCu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式 。
若要将Cu完全溶解,至少加入H2SO4的物质的量是 。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:选择题
下列药品和装置合理,能完成相应实验的是
A | B | C | D |
|
|
|
|
碳酸氢钠受热分解 | 二氧化碳喷泉式样 | 乙二酸和乙二醇酯化反应 | 实验室制氨气 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:填空题
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)写出甲醚 燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为 ;
燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)═CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3 的产率将 (填“变
的产率将 (填“变 大”、“变小”或“不变”,下同),混合气体的平均式量将 ;
大”、“变小”或“不变”,下同),混合气体的平均式量将 ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在不同情况下测得A(g)+3B(g)  2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
A.υ(D)=0.4 mol·L-1·s-1 B.υ(C)=0.5 mol·L-1·s-1
C.υ(B)=0.6 mol·L-1·s-1 D.υ(A)=0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:填空题
镉镍可充电电池在现代生活中有着广泛的应用,它的充、放电反应如下:
Cd+2NiOOH+2H2O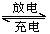 Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
请回答下列问题:
(1)上述反应式中左边物质的总能量________(填“大于”“小于”或“等于”)右边物质的总能量。
(2)放电时负极发生反应的物质是________ ,
正极的电极反应式为__________________ 。
(3)镉镍废旧电池必须进行回收并集中处理,最主要的原因是____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:填空题
某温度(T℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,该温度下水的KW= 。该温度(填“大于”、“小于”或“等于”) 25℃,其理由是 。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va:Vb= 。
(2)若所得混合溶液为中性,且a+b=12,则Va:Vb= 。
(3)若所得混合溶液的pH=10,且a=12,b=2,Va:Vb= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com