
(10·Ö)µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŌ×ÓŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ”£
(1)25”ꏱ£¬0.1mol/LNH4NO3ČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č £ØĢī”°“óÓŚ”±”¢”°µČÓŚ”±»ņ”°Š”ÓŚ”±£© 0.1mol/L NaOHČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č”£
(2)Čō½«0.1mol/L NaOHČÜŅŗŗĶ0.2mol/LNH4NO3ČÜŅŗµČĢå»ż»ģŗĻ£¬»ģŗĻČÜŅŗÖŠ
2c(NH4+)£¾c(NO3£)£¬ĖłµĆČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ ”£
(3)·¢É仚¼żŹ±ėĀ(N2H4)ĪŖČ¼ĮĻ£¬¶žŃõ»ÆµŖ×÷Ńõ»Æ¼Į£¬Į½Õß·“Ӧɜ³ÉµŖĘųŗĶĘųĢ¬Ė®”£¾²ā¶Ø16gĘųĢåŌŚÉĻŹö·“Ó¦ÖŠ·Å³ö284kJµÄČČĮ攣
ŌņøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ ”£
(4)ÓŅĶ¼ŹĒ1mol NO2ŗĶ1mol CO·“Ӧɜ³ÉCO2ŗĶNO¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼”£
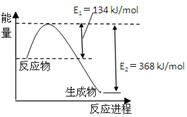
ŅŃÖŖ£ŗN2(g)£«O2(g)£½2NO(g) ”÷H£½£«180kJ/mol
2NO (g)£«O2(g)£½N2(g)£«2CO2(g) ”÷H£½£112.3kJ/mol
Ōņ·“Ó¦£ŗ2NO(g)£«CO(g) N2(g)£«2CO2(g)µÄ”÷HŹĒ ”£
N2(g)£«2CO2(g)µÄ”÷HŹĒ ”£
£Ø1£©“óÓŚ
£Ø2£©c(NO3£)£¾c(NH4+)£¾c(Na+)£¾c(OH£)£¾c(H+)
£Ø3£©2N2H4(g)£«2NO2(g)£½3N2(g)£«2H2O (g) ”÷H£½£1136kJ/mol
£Ø4£©£760.3kJ/mol
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ(1)NH4+»įĖ®½ā£¬“Ł½ųĮĖĖ®µÄµēĄė£¬¶ųOH”ŖŅÖÖĘĮĖĖ®µÄµēĄė£¬Ņņ“Ė£¬0.1mol/L
NH4NO3ČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č“óÓŚ0.1mol/L NaOHČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č”£
(2)Į½ČÜŅŗ»ģŗĻŗó£¬ĖłµĆČÜŅŗµÄČÜÖŹĪŖNaNO3”¢NH3”¤H2O”¢NH4NO3”£ŅņČÜŅŗÖŠ2c(NH4+)£¾c(NO3£)£¬¹ŹNH3”¤H2OµÄµēĄė“óÓŚNH4+µÄĖ®½ā£¬Ņņ“ĖČÜŅŗ³Ź¼īŠŌ£¬¹Źø÷Ąė×ÓµÄÅØ¶Č“óŠ”ĪŖ
c(NO3£)£¾c(NH4+)£¾c(Na+)£¾c(OH£)£¾c(H+)
(3)N2H4ÓėNO2·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2N2H4+2NO2=3N2+4H2O£»ŅŃÖŖ16g£Ø¼“0.5mol£©ĘųĢåŌŚÉĻŹö·“Ó¦ÖŠ·Å³ö284kJµÄČČĮ棬ŌņÉč2moløĆĘųĢå·“Ó¦·Å³öµÄČČĮæĪŖx£¬æɵƵȏ½£ŗ
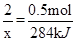 x=1136kJ£¬ĖłŅŌ£¬“ĖČČ»Æѧ·½³ĢŹ½ĪŖ2N2H4(g)£«2NO2(g)£½3N2(g)£«2H2O (g) ”÷H£½£1136kJ/mol
x=1136kJ£¬ĖłŅŌ£¬“ĖČČ»Æѧ·½³ĢŹ½ĪŖ2N2H4(g)£«2NO2(g)£½3N2(g)£«2H2O (g) ”÷H£½£1136kJ/mol
(4)øł¾ŻøĒĖ¹¶ØĀÉ£¬æɼĘĖćĒóµĆ“Ė·“Ó¦µÄ”÷H=£760.3kJ/mol
æ¼µć£ŗµē½āÖŹČÜŅŗ£»ČČ»Æѧ
µćĘĄ£ŗ±¾ĢāÖ÷ŅŖæ¼²éĮĖµē½āÖŹČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”µÄ±Č½Ļ”¢ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“µČÄŚČŻ”£
¶ŌÓŚČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”µÄ±Č½Ļ£¬Šč³ä·Öæ¼ĀĒČÜŅŗÖŠĄė×ÓµÄĖ®½āÓėµēĄė£»
¶ŌÓŚČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£¬Ó¦×¢ŅāÓėĘÕĶØ»Æѧ·½³ĢŹ½ŹéŠ“µÄĒų±š£¬Ķ¬Ź±·“Ó¦ČČµÄ¼ĘĖćÖ÷ŅŖÓ¦ÓĆøĒĖ¹¶ØĀÉ”£


 ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
(10·Ö)µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŅ»ÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
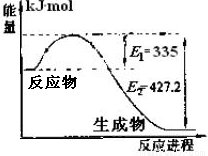
£Ø1£©ÓŅĶ¼ŹĒN2ŗĶH2·“Ӧɜ³É2molNH3¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬Ēė¼ĘĖćĆæÉś³É1molNH3·Å³öČČĮæĪŖ ”£
£Ø2£©ŌŚ¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ»Æѧ·“Ó¦£ŗN2(g)+3H2(g)2NH3(g)£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
| t/K | 298 | 398 | 498 | ”” |
| K/(mol”¤L”Ŗ1)”Ŗ2 | 4.1”Į106 | K1 | K2 | ”” |
ĒėĶź³ÉĻĀĮŠĪŹĢā£ŗ
¢ŁŹŌ±Č½ĻK1”¢K2µÄ“󊔣¬K1 K2£ØĢīŠ“”°>”±”°=”±»ņ”°<”±£©
¢ŚĻĀĮŠø÷ĻīÄÜ×÷ĪŖÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻµÄŹĒ £ØĢīŠņŗÅ×ÖÄø£©”£
””””A£®ČŻĘ÷ÄŚN2”¢H2”¢NH3µÄÅضČÖ®±ČĪŖ1£ŗ3£ŗ2””””B£®2v(N2)(Õż)= v(H2)(Äę)
””””C£®ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä ””””D£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
£Ø3£©ŃĪĖįėĀ£ØN2H6Cl2£©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ŹōÓŚĄė×Ó»ÆŗĻĪļ£¬Ņ×ČÜÓŚĖ®£¬ČÜŅŗ³ŹĖįŠŌ£¬Ė®½āŌĄķÓėNH4ClĄąĖĘ”£
””¢ŁŠ“³öŃĪĖįėĀµŚŅ»²½Ė®½ā·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
””¢ŚŃĪĖįėĀĖ®ČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ¹ŲĻµ±ķŹ¾ÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©”£
””””A£®c(Cl”Ŗ)>c(N2H62+)>c(H+)>c(OH”Ŗ)
””””B£®c(Cl”Ŗ)>c([N2H5”¤H2O]+)>c(OH”Ŗ)>c(H+)
””””C£®2c(N2H62+)+c([N2H5”¤H2O]+)+ c(H+) =c(Cl”Ŗ)+c(OH”Ŗ)
””””D£®c(N2H62+) > c(Cl”Ŗ)> c(H+)>c(OH”Ŗ)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğĖÄ“ØŹ”ÄĻÉ½ÖŠŃ§ø߶ž10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
(ĆææÕ1·Ö ¹²10·Ö)µŖŹĒµŲĒņÉĻ¼«ĪŖ·įø»µÄŌŖĖŲ”£
£Ø1£© Li3N¾§ĢåÖŠµŖŅŌN3£µÄ“ęŌŚ£¬»łĢ¬N3£µÄµē×ÓÅŲ¼Ķ¼ĪŖ ”£
£Ø2£©N”ŌNµÄ¼üÄÜĪŖ942 kJ”¤mol-1£¬NØCNµ„¼üµÄ¼üÄÜĪŖ247 kJ”¤mol-1£¬¼ĘĖćĖµĆ÷N2ÖŠµÄ ¼ü±Č ¼üĪČ¶Ø£ØĢī”°¦Ņ”±»ņ”°¦Š”±£©”£
£Ø3£©(CH3)3NH+ŗĶAlCl4-æÉŠĪ³ÉĄė×ÓŅŗĢ唣Ąė×ÓŅŗĢåÓÉŅõ”¢ŃōĄė×Ó×é³É£¬ČŪµćµĶÓŚ100”ę£¬Ęä»Ó·¢ŠŌŅ»°ć±ČÓŠ»śČܼĮ £ØĢī”°“ó”±»ņ”°Š””±£©£¬æÉÓĆ×÷ ”££ØĢī“śŗÅ£©
a£®ÖśČ¼¼Į b£®”°ĀĢÉ«”±ČܼĮ c£®ø“ŗĻ²ÄĮĻ d£®¾ųČČ²ÄĮĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014½ģĖÄ“ØŹ”ø߶ž10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(ĆææÕ1·Ö ¹²10·Ö) µŖŹĒµŲĒņÉĻ¼«ĪŖ·įø»µÄŌŖĖŲ”£
£Ø1£© Li3N¾§ĢåÖŠµŖŅŌN3£µÄ“ęŌŚ£¬»łĢ¬N3£µÄµē×ÓÅŲ¼Ķ¼ĪŖ ”£
£Ø2£©N”ŌNµÄ¼üÄÜĪŖ942 kJ”¤mol-1£¬NØCNµ„¼üµÄ¼üÄÜĪŖ247 kJ”¤mol-1£¬¼ĘĖćĖµĆ÷N2ÖŠµÄ ¼ü±Č ¼üĪČ¶Ø£ØĢī”°¦Ņ”±»ņ”°¦Š”±£©”£
£Ø3£©(CH3)3NH+ŗĶAlCl4-æÉŠĪ³ÉĄė×ÓŅŗĢ唣Ąė×ÓŅŗĢåÓÉŅõ”¢ŃōĄė×Ó×é³É£¬ČŪµćµĶÓŚ100”ę£¬Ęä»Ó·¢ŠŌŅ»°ć±ČÓŠ»śČܼĮ £ØĢī”°“ó”±»ņ”°Š””±£©£¬æÉÓĆ×÷ ”££ØĢī“śŗÅ£©
a£®ÖśČ¼¼Į b£®”°ĀĢÉ«”±ČܼĮ c£®ø“ŗĻ²ÄĮĻ d£®¾ųČČ²ÄĮĻ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗŌĄŃōŹŠ2010½ģøßČżµŚĖÄ“ĪÖŹ¼ģæ¼ŹŌ£Ø»Æѧ£©ŹŌĢā ĢāŠĶ£ŗŹµŃéĢā
(10·Ö)µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŅ»ÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÓŅĶ¼ŹĒN2ŗĶH2·“Ӧɜ³É2molNH3¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬Ēė¼ĘĖćĆæÉś³É1molNH3·Å³öČČĮæĪŖ ”£
£Ø2£©ŌŚ¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ»Æѧ·“Ó¦£ŗN2(g)+3H2(g) 2NH3(g)£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
2NH3(g)£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKÓėtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
|
t/K |
298 |
398 |
498 |
”” |
|
K/(mol”¤L”Ŗ1)”Ŗ2 |
4.1”Į106 |
K1 |
K2 |
”” |
ĒėĶź³ÉĻĀĮŠĪŹĢā£ŗ
¢ŁŹŌ±Č½ĻK1”¢K2µÄ“󊔣¬K1 K2£ØĢīŠ“”°>”±”°=”±»ņ”°<”±£©
¢ŚĻĀĮŠø÷ĻīÄÜ×÷ĪŖÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻµÄŹĒ £ØĢīŠņŗÅ×ÖÄø£©”£
””””A£®ČŻĘ÷ÄŚN2”¢H2”¢NH3µÄÅضČÖ®±ČĪŖ1£ŗ3£ŗ2””””B£®2v(N2)(Õż)= v(H2)(Äę)
””””C£®ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä ””””D£®»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
£Ø3£©ŃĪĖįėĀ£ØN2H6Cl2£©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ŹōÓŚĄė×Ó»ÆŗĻĪļ£¬Ņ×ČÜÓŚĖ®£¬ČÜŅŗ³ŹĖįŠŌ£¬Ė®½āŌĄķÓėNH4ClĄąĖĘ”£
””¢ŁŠ“³öŃĪĖįėĀµŚŅ»²½Ė®½ā·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
””¢ŚŃĪĖįėĀĖ®ČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ¹ŲĻµ±ķŹ¾ÕżČ·µÄŹĒ £ØĢīŠņŗÅ£©”£
””””A£®c(Cl”Ŗ)>c(N2H62+)>c(H+)>c(OH”Ŗ)
””””B£®c(Cl”Ŗ)>c([N2H5”¤H2O]+)>c(OH”Ŗ)>c(H+)
””””C£®2c(N2H62+)+c([N2H5”¤H2O]+)+ c(H+) = c(Cl”Ŗ)+c(OH”Ŗ)
””””D£®c(N2H62+) > c(Cl”Ŗ)> c(H+) >c(OH”Ŗ)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com