
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
A.N5+共有34个核外电子 B.N5+中氮原子间以共价键结合
C.化合物N5ASF6中AS的化合价为+1价 D.化合物N5ASF6中F的化合价为 -1价
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2013-2014山西省汾阳市高一期末统考化学试卷(解析版) 题型:选择题
在一定温度下,可逆反应A(g)+3B(g) 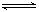 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A.C生成的速率与A分解的速率2倍相等
B.单位时间生成n mol A,同时生成3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:选择题
在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na,Mg,Al B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag D.Mg,Al,Zn,Fe
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:填空题
(6分)下表是元素周期表的一部分,请回答有关问题:
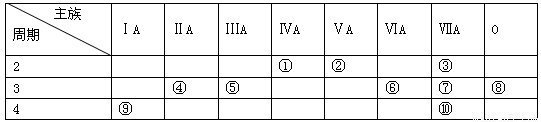
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
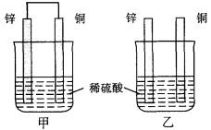
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大 D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:实验题
( 11分)乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3 溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH 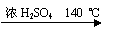 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)
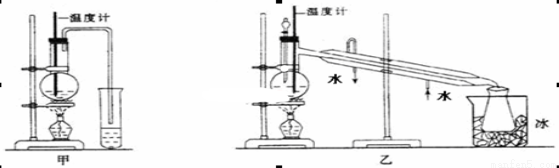
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_______(填“甲”或“乙”)最合理,理由是_____________。
(2)反应液中应加入沸石,其作用是____________。
(3)反应中温度计的正确位置是水银球置于________________________。
(4)用上述装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是________________________________。
(5)如果温度太高(如170℃),将会发生一个有机副反应,反应方程式为:____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:填空题
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。

⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 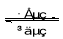 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com