
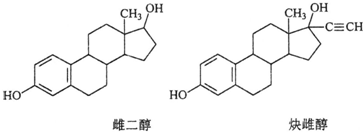
| A、核磁共振氢谱峰数相同 |
| B、均能发生加成反应、取代反应、消去反应 |
| C、两种分子中所有碳原子不可能在同一个平面内 |
| D、可用FeCl3溶液鉴别 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、常温常压下是无色无味气体 |
| B、在通常状况下,密度比空气小 |
| C、能使酸性KMnO4溶液褪色 |
| D、在一定条件下能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 高温 |
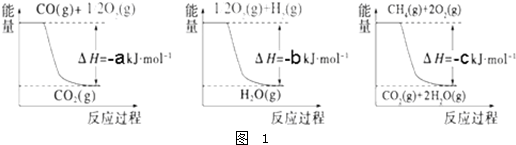
| 高温高压 |
| 催化剂 |
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol?L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L-1) | ρ1 | ρ2 |
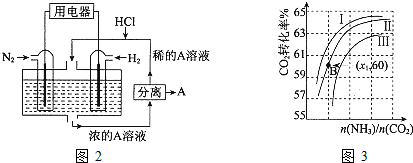
| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过1H核磁共振谱图可以区分乙醇和乙酸乙酯 |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有共用电子对数目为1.2NA(设NA为阿伏加德罗常数的值.) |
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA(设NA为阿伏加德罗常数的值.) |
| D、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氨水中加水稀释后,溶液中除了H2O以外其他粒子浓度都下降 |
| B、若NaHC2O4溶液的pH=5,则溶液中c(C2O42-)<c(H2C2O4) |
| C、pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液体积的m倍和n倍,若稀释后两溶液的pH仍相同,则m<n |
| D、室温下,pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比为106:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1L 0.1mol/L的醋酸溶液中所含分子数目小于0.1NA |
| B、质量相同的N2和CO中,含有的电子数均为14NA |
| C、标准状况下,11.2L氮气和22.4L氢气在一定条件下充分反应,原子数目小于3NA |
| D、在V L 0.1mol/L的氯化铁溶液中,若Fe3+的数目为NA,Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
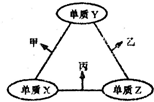 x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )| A、X元素位于第ⅣA族 |
| B、热稳定性:乙<丙 |
| C、甲和丙可能发生氧化还原反应 |
| D、分子乙中各原子均达8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应:Cu2++S2-═CuS↓ |
| C、1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| D、Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g O3含有NA个O3 |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com