
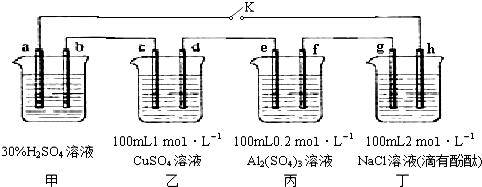
分析 甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现g电极附近的溶液变红,说明g电极是电解池的阴极,h是电解池的阳极;所以a为正极,b为负极;c电极为阴极,d为阳极;e电极为阴极,f为阳极;20min后,将K断开,此时c、d两极上产生的气体体积相同,
(1)依据分析判断电极名称;
(2)丙中电解水;
(3)c、d两极上产生的气体体积相同,c电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑,d电极上发生的电极反应为:4OH--4e-=2H2O+O2↑,根据电子守恒计算生成的Cu、氢气和氧气的物质的量;
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,氢气在c极失电子,氧气在d极得电子;
(5)d极生成0.1mol氧气,转移0.4mol电子,丁装置中含有0.2molNaCl,阳极分别发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,阴极发生2H++2e-=H2↑,结合电极方程式计算.
解答 解:甲池是原电池做电源,发生的反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O;乙丙丁是电解池,闭合K,发现G电极附近的溶液变红,说明G电极是电解池的阴极,H是电解池的阳极;所以a为正极,b为负极;c电极为阴极,d为阳极;e电极为阴极,f为阳极;20min后,将K断开,此时c、d两极上产生的气体体积相同,
(1)a电极是铅蓄电池的正极,正极的电极材料是PbO2;
故答案为:PbO2;
(2)丙中电解硫酸铝,其实际上是电解水,其电解方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
故答案为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
(3)c、d两极上产生的气体体积相同,c电极上发生的电极反应为:Cu2++2e-=Cu;2H++2e-=H2↑,d电极上发生的电极反应为:4OH--4e-=2H2O+O2↑,
设生成的氧气为xmol,则氢气也为xmol,生成的Cu为0.1L×1mol/L=0.1mol,由得失电子可得:2x+0.1×2=4x,解得x=0.1mol,
则电解时生成0.1mol氢气、0.1mol氧气和0.1molCu,若要恢复到原来的状态,需要加入0.1molCu(OH)2;
故答案为:Cu(OH)2;0.1mol;
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连上灵敏电流计,发现电流计指针偏转,说明形成了原电池反应,氢气在c极失电子,c为负极,氧气在d极得电子,正极的反应为:O2+4H++4e-=2H2O;
故答案为:负;O2+4H++4e-=2H2O;
(5)d极生成0.1mol氧气,转移0.4mol电子,丁装置中含有0.2molNaCl,阳极分别发生2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,阴极发生2H++2e-=H2↑,则阳极上先生成0.1mol氯气,再生成0.05mol氧气,阴极生成0.2mol氢气,共生成0.35mol气体,故答案为:0.35.
点评 本题考查了原电池和电解池原理在计算中的应用等,正确判断原电池正负极和电解池的阴阳极、以及电极方程式的书写方法是解本题关键,根据离子放电顺序确定阴阳极电极反应,并结合得失电子守恒解答,难度中等.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙炔分子所含的共用电子对总数为5NA | |
| B. | 1 mol甲基(-CH3 )所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有碳碳双键总数为NA | |
| D. | 标准状况下,22.4L己烷完全燃烧所生成的气态产物的分子数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- K+[Al(OH)4]- OH- | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Mg2+ K+ Cl- | D. | NH4+ NO3- CO32- Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫具有还原性,可用二氧化硫水溶液吸收溴蒸气 | |
| B. | 氢氟酸具有强酸性,可用氢氟酸蚀刻玻璃 | |
| C. | 氨气具有氧化性,可用浓氨水检验氯气管道是否泄漏 | |
| D. | SiO2的导电能力强,可用于制造通讯光缆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在复盐NH4Fe(SO4)2溶液中加入过量的Ba(OH)2溶液:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| B. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| C. | 在燃煤时加入适量石灰石粉末,可减少SO2的排放:CaCO3+SO2═CaSO3+CO2 | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com