
| A. | 在pH=12溶液中:Na+、Ca2+、HCO3-、ClO- | |
| B. | 在能使石蕊变红的溶液中:Mg2+、K+、Br-、SO4 2- | |
| C. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| D. | 在与Al 反应能放出H2 的溶液中:Fe2+、K+、NO3-、SO4 2- |
分析 A.pH=12的溶液中存在大量氢氧根离子,碳酸氢根离子与氢氧根离子反应;
B.在能使石蕊变红的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
C.碳酸氢钠与铝离子发生双水解反应;
D.该溶液呈酸性或强碱性,亚铁离子与氢氧根离子反应,酸性条件下硝酸根离子能够氧化亚铁离子.
解答 解:A.在pH=12溶液呈碱性,溶液中存在大量氢氧根离子,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.在能使石蕊变红的溶液呈酸性,溶液中存在大量氢离子,Mg2+、K+、Br-、SO42-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.NaHCO3、Al3+之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.在与Al 反应能放出H2 的溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中一定不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
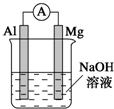 将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )
将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示.此电池工作时,下列叙述正确的是( )| A. | Mg比Al活泼,Mg失去电子被氧化成Mg2+ | |
| B. | 铝条表面虽有氧化膜,但可不必处理 | |
| C. | 该电池的内电路中,阳离子向负极迁移 | |
| D. | Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
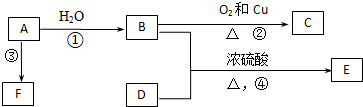

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、CuSO4•5H2O、苛性钾 | B. | 硫酸、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧| A. | 标准状况下,11.2LN2中含电子总数为5 NA | |
| B. | 标准状况下,22.4LN2 H4 中所含原子总数为6 NA | |
| C. | 标准状况下,3.2gN 2H4 中含有共价键的总数为0.6 NA | |
| D. | 若生成3.6gH2 O,则上述反应转移电子的数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的电极一定要由两种不同的金属组成 | |
| B. | 原电池的负极得电子,发生还原反应 | |
| C. | 原电池工作时,其正极不断产生电子并经外电路流向负极 | |
| D. | 原电池能将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验乙炔中是否混有H2S:湿润的醋酸铅试纸 | |
| B. | 盐酸滴定NaHCO3溶液:酚酞 | |
| C. | 检验淀粉是否完全水解:碘水 | |
| D. | 检验氯化氢是否集满:湿润的pH试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com