
(1)为了防止水源污染,用简单而又现象明显的方法 检验某工厂排放的污水中含有苯酚,实验操作是___________________________________________________。从废水中回收苯酚的方法是:①取有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚从有机溶剂中脱离;③通入某物质又析出苯酚。试写出②、③步的化学方程式______________________________;__________________________________。
(2)某醛的结构简式为 
检验分子中醛基的所用的试剂是________________,化学方程式为____________;
然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是____________;
(3)做过银镜反应的试管内壁的一层银,可用_________除去。(写化学式)
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3 -)+ 2c(CO32-)+ c(H2CO3)
C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) =l.0 × l0-a,该溶液的pH=7+0.5a
D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下有:①6.72 L CH4,②3.01×1023个HCl分子,③13.6 g H2S,④0.2 mol NH3。下列对这四种气体的描述正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abd D.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同分异构体判断正确的是
A.分子式为C2H6O的同分异构体有两个,分别是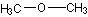 和CH3CH2OH
和CH3CH2OH
B.分子式为C8H10的芳香烃有3个,分别为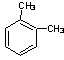 、
、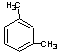 和
和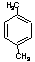
C.分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3
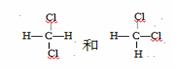 |
D.二氯甲烷是四面体结构, 是同一个物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是
A.Fe(OH)2溶液中加入HNO3溶液:Fe(OH)2+2H+=2H2O+Fe2+
B.盐酸除去铜器表面的铜绿:Cu2(OH)2CO3+4H+=3H2O+2Cu2++CO2↑
C.氯气可以降低的SO2的漂白性:SO2+Cl2+2H2O=2Cl—+4H++SO42—
D.CO2通入饱和碳酸钠溶液:CO2+ CO32—+2Na++H2O=2NaHCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g)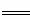 Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):

①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化合物的结构(键线式)及球棍模型如下:
|
|
|
该有机分子的核磁共振波谱图如下(单位是ppm)。

下列关于该有机物的叙述正确的是
A.该有机物不同化学环境的氢原子有8种 B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为-CH3 D.该有机物不可能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.同主族元素的简单阴离子还原性越强,则对应元素的非金属性越强
B.第二周期元素从左到右,最高正价从+1递增到+7
C.IA族与ⅦA族元素间可形成共价化合物或离子化合物
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com