
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
| C、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |


科目:高中化学 来源: 题型:
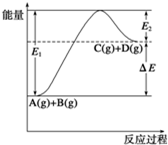
| A、1mol A与1mol B充分反应后,能量变化为△E |
| B、加入催化剂后,反应加快,△E减小 |
| C、反应物的总键能小于生成物的总键能 |
| D、反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能用植物油萃取溴水中的溴 |
| B、皂化是高分子生成小分子的过程 |
| C、和H2加成后能提高其熔点及稳定性 |
| D、水解可得到丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF的沸点比HCl的沸点高,是由于HF分子间存在氢键作用 |
| B、H2O加热到很高温度都难以分解,是因为水分子间有氢键作用 |
| C、水在结冰时体积膨胀,是由于水分子间存在氢键作用 |
| D、在氨水中水分子和氨分子之间也存在着氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2011年3月11日,日本发生大地震,并引发核电厂爆炸,核反应属于物理变化 |
| B、“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关 |
| C、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| D、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可由pH=3的HCl与pH=11的NH3?H2O溶液等体积混合而成 |
| B、该溶液中离子间一定满足:c(NH4+)+c(H+)=c(OH-)+c(Cl-) |
| C、加入适量NH3?H2O,溶液中离子浓度可能为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、该溶液可能由等物质的量浓度、等体积的HCl溶液和NH3?H2O溶液混合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com