
A、氯化氢的电子式H+[:
| ||||
B、镁的原子结构示意图 | ||||
| C、次氯酸的结构式 H-Cl-O | ||||
| D、实验室制取氯气的离子方程式MnO2+4HCl(浓)=Cl2+Mn2++2H2O |
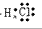 ,故A错误;
,故A错误; ,故B正确;
,故B正确;
| ||


科目:高中化学 来源: 题型:
| A、NaHSO4 |
| B、NaCl |
| C、HCl |
| D、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
| A、25℃时,CuS的溶解度大于MnS的溶解度 |
| B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol?L-1 |
| C、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
| D、除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与水反应 |
| B、能与氢氧化钠溶液反应 |
| C、能与硫酸反应 |
| D、能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,它们的物质的量必相同 |
| B、常温常压下,等质量的N2与CO所含分子数相同 |
| C、V L O2的质量一定比V L CO2的质量小 |
| D、A容器中的H2与B容器中的NH3所含原子总数相等,由两容器的体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,试回答:
,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
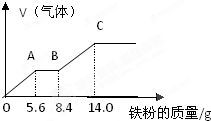 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)
某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)查看答案和解析>>
科目:高中化学 来源: 题型:

| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  | 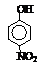 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com