
| A. | △H1<0 | B. | △H2>0 | C. | △H1=△H3-2△H2 | D. | 2△H4>△H5 |
分析 A.CO2(g)+C(s)═2CO(g)为吸热反应;
B.燃烧为放热反应;
C.①CO2(g)+C(s)═2CO(g)△H1
②CO(g)+$\frac{1}{2}$O2(s)═CO2(g)△H2
③C(s)+O2(g)═CO2(g)△H3
由盖斯定律可知,③-②×2得到①;
D.CuO(s)+CO(g)═Cu(s)+CO2(g)与2CuO(s)+C(s)═2Cu(s)+CO2(g)中反应物不同.
解答 解:A.CO2(g)+C(s)═2CO(g)为吸热反应,则△H1>0,故A错误;
B.CO(g)+$\frac{1}{2}$O2(s)═CO2(g)为放热反应,则△H2<0,故B错误;
C.①CO2(g)+C(s)═2CO(g)△H1
②CO(g)+$\frac{1}{2}$O2(s)═CO2(g)△H2
③C(s)+O2(g)═CO2(g)△H3
由盖斯定律可知,③-②×2得到①,则△H1=△H3-2△H2,故C正确;
D.CuO(s)+CO(g)═Cu(s)+CO2(g)与2CuO(s)+C(s)═2Cu(s)+CO2(g)中反应物不同,则不能比较的2△H4与△H5大小,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 实验 序号 | 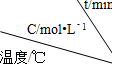 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
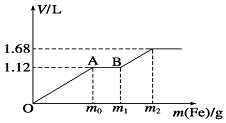 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
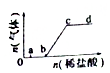 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- | |
| C. | c点对应的溶被中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
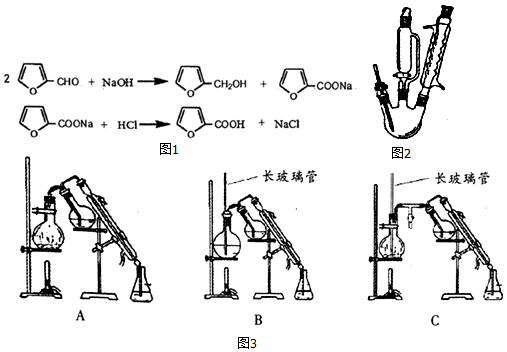
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com