


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.1 :7 | B.7 :1 | C.7 :8 | D.8 :7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+ | B.Cu2+ | C.Fe2+ | D.Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Fe3++Cu===2Fe2++Cu2+成立说明氧化性:Fe3+> Cu 2+ |
| B.25℃,pH=0的溶液中,Al3+、NH4+、NO3—、Fe2+可以大量共存 |
| C.5.6 g铁与足量的氯气反应失去电子为0.2 mol |
| D.硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变红色 |
查看答案和解析>>
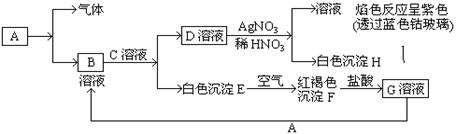
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
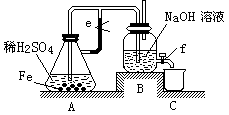
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
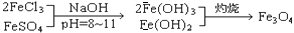
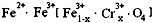 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com