
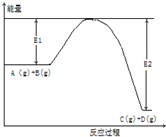
 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.分析 (1)由图可知,反应物总能量大于生成物总能量,则该反应为放热反应;
(2)正反应为放热反应,升高温度平衡逆向移动;
(3)使用催化剂改变反应途径,反应热只与始态、状态有关,与反应途径无关;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,参加反应A的物质的量为0.5mol,则:
A(g)+B(g)?C(g)+2D(g)
起始浓度(mol/L):0.5 1 0 0
变化浓度(mol/L):0.25 0.25 0.25 0.5
平衡浓度(mol/L):0.25 0.75 0.25 0.5
根据v=$\frac{△c}{△t}$计算v(D),根据K=$\frac{c(C)×{c}^{2}(D)}{c(A)×c(B)}$计算平衡常数.
解答 解:(1)由图可知,反应物总能量大于生成物总能量,则该反应为放热反应,
故答案为:放热;
(2)正反应为放热反应,升高温度平衡逆向移动,A的转化率减小,
故答案为:减小;正反应是放热反应,升高温度反应向逆反应方向移动;
(3)使用催化剂改变反应途径,反应热只与始态、状态有关,与反应途径无关,故△H不变,
故答案为:不变;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,参加反应A的物质的量为0.5mol,则:
A(g)+B(g)?C(g)+2D(g)
起始浓度(mol/L):0.5 1 0 0
变化浓度(mol/L):0.25 0.25 0.25 0.5
平衡浓度(mol/L):0.25 0.75 0.25 0.5
则v(D)=$\frac{0.5mol/L}{5min}$=0.1mol/(L?min),
平衡常数K=$\frac{c(C)×{c}^{2}(D)}{c(A)×c(B)}$=$\frac{0.25mol/L×(0.5mol/L)^{2}}{0.25mol/L×0.75mol/L}$=0.33 mol/L,
故答案为:0.1mol/(L?min);0.33 mol/L.
点评 本题考查化学平衡计算与影响因素、平衡常数、反应速率计算、化学反应中能量变化等,比较基础,注意掌握三段式在化学平衡计算中应用.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | HA与BOH的电离常数相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com