
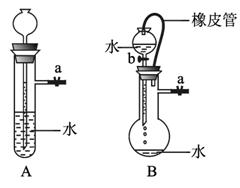
图1-5-3
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?________ (填“漏气”“不漏气”或“无法确定”),判断理由:____________________________________________________________________。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?________ (填“漏气”“不漏气”或“无法确定”),判断理由:________
____________________________________________________________________。
解析:本题主要考查装置气密性检验,具有创新性,涉及气体制备、气体收集、气体反应等的仪器装置都要先进行气密性检查。检验实验装置气密性的原理是:通过气体发生器与附设的液体构成密封体系,依据改变体系内压强时产生现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性好坏。检查的方法有微热法(基本法)、液差法、液封法等。
(1)如果该装置漏气,加水后试管内气体逸出,体积减小,长颈漏斗内的水面与试管内的水面应一样高。
(2)由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强始终相同,即使装置不漏气,分液漏斗中的液体也会在重力作用下滴入烧瓶。
答案:(1)不漏气 只有装置不漏气,长颈漏斗内的水面才能保持高于试管内的水面,试管内气压才能大于外界大气压
(2)无法确定 分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| NH | + 4 |
| C2O | 2- 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分) 地下水中硝酸根离子、亚硝酸根离子会造成地下水污染,目前地下水中硝酸根离子经济可行的脱氮方法是在合适的催化剂作用下,用还原剂(如HCOONa)将硝酸根离子还原为氮气而脱氮。
某化学研究性学习小组的同学在技术人员指导下,研究水样中硝酸根起始浓度为100 mg?L- 1条件下,用一定量的催化剂,以甲酸钠进行反硝化脱氮的效率及脱氮的最佳条件,实验中控制起始pH=4.5。经测定得到图1、图2及图3如下。
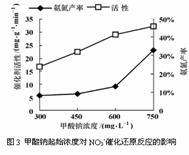


(1)地下水中硝酸盐可能来源于 ,地下水中硝酸盐含量的增大不仅影响人类和生物体的身体健康,还可能引起 等环境问题。(填一项)
(2)请写出用甲酸钠脱氮的主要离子方程式: 。
(3)分析图1,下列有关说法正确的是( )
A. NO2- 是反应过程中的中间产物
B.NH4+是反应中的一种副产物
C.反应30min后NO3-脱除速率降低,是因为硝酸根离子浓度降低
D.反应进行到75min时,溶液中含氧酸根离子脱除率最高
(4)由图2、图3分析,在本题实验条件下,用甲酸钠进行反硝化脱氮的合适条件:催化剂投入量为 ,甲酸钠起始浓度为 。
(5)根据图1计算,当反应进行至75min时,若NH4+浓度为3.8 mg?L-1,此时水样中氮的脱除效率为 %。(假设实验过程中溶液体积不变,结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式 ,在图1中曲线 (填“a” 或“b”)表示加入铁触媒的能量变化曲线。
图1 图2
 [
[
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是
A.3v(H2)正=2v(NH3)逆 B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变 D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
| ⅰ | 450 | 1/3 | 1 |
| ⅱ | _ | _ | 10 |
| ⅲ | 480 | _ | 10 |
A.请在上表空格中填入剩余的实验条件数据。
 B.根据反应N2+ 3H2
B.根据反应N2+ 3H2![]() 2NH3的特点,在给出的坐标图2中,
2NH3的特点,在给出的坐标图2中,
画出其在1MPa和10MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
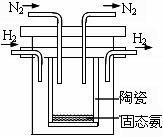
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com