
 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 6-2×3 |
| 2 |
| 6-2×2 |
| 2 |


科目:高中化学 来源:2011-2012学年天津市天津一中高一下学期期末考试化学试卷(带解析) 题型:填空题
(11分)如下图所示:已知A、D、E、F是中学化学中常见单质,B、C是氧化物,且B的相对分子质量是232。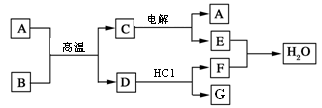
请填空:
(1) A是________,E是________(填化学式)
(2) C电解的化学方程式为________________________。
(3) 写出工业以B为原料冶炼D的化学方程式___________________、_________________。
(4) 熔融状态下,金属钠和G能组成可充电电池(装置示意图如下),反应原理为:Na + G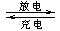 NaCl +D
NaCl +D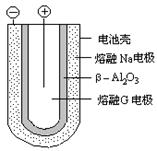
放电时,正极反应为___________________,阳离子迁移途径为________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州、南通、泰州、宿迁四市高三第二次调研测试化学试卷(解析版) 题型:推断题
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子。R+核外有28个电子。请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
(1)E、G、M的第一电离能由大到小的顺序为 。
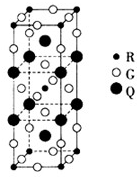
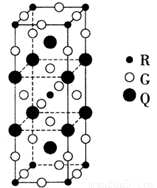
(2)下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价。基态R2+的核外电子排布式为 ;Q的化合价为 价。
(3)1 mol晶体L中含有δ键的数目为 。
(4)G与M可形成MG3与MG2,MG3分子的空间构型是 ,MG2中M原子的杂化方式是 。
(5)在(EA4)2R(MG4)2中存在的化学键除极性键外,还有 (填字母)。
a.离子键 b. 氢键 c.配位键 d.金属键
查看答案和解析>>
科目:高中化学 来源:2014届天津市高一下学期期末考试化学试卷(解析版) 题型:推断题
(11分)如下图所示:已知A、D、E、F是中学化学中常见单质,B、C是氧化物,且B的相对分子质量是232。

请填空:
(1) A是________,E是________(填化学式)
(2) C电解的化学方程式为________________________。
(3) 写出工业以B为原料冶炼D的化学方程式___________________、_________________。
(4) 熔融状态下,金属钠和G能组成可充电电池(装置示意图如下),反应原理为:Na + G NaCl +D
NaCl +D

放电时,正极反应为___________________,阳离子迁移途径为________________________。
查看答案和解析>>
科目:高中化学 来源:浙江省期中题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com