
【题目】有机化合物对人类的生活和社会发展具有极其重要的意义。请回答下列问题:
(1)人们认为苯是一种不饱和烃,但是苯不能使溴水褪色,性质类似烷烃,写出苯与液溴发生取代反应的化学方程式_____________________________________________
(2)1834年德国科学家米希尔里希,通过蒸馏安息香酸(![]() 即苯甲酸)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热(与NaOH反应)生成苯的化学方程式_____________________________
即苯甲酸)和石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热(与NaOH反应)生成苯的化学方程式_____________________________
(3)某烷烃碳架结构如图所示:![]() ,此烷烃的一溴代物有_________种;若此烷烃为单烯烃加氢制得,则此烯烃的结构有__________种。
,此烷烃的一溴代物有_________种;若此烷烃为单烯烃加氢制得,则此烯烃的结构有__________种。
(4)某有机物由C、H、O三种元素组成,球棍模型如图所示:
写出此有机物与金属钠反应的化学方程式_________________________________
(5)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用下列装置来制备。

完成下列填空:
①实验时,加入药品的顺序是______________,该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并_____________ 。
②反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、静置,然后分液。
③若用b装置制备乙酸乙酯,其缺点有__________________(答一条即可)。
【答案】 ![]()
![]() 6 5 2CH2=CHCOOH+2Na → 2CH2=CHCOONa+H2↑ 乙醇、浓硫酸、乙酸 加热 振荡 原料损失较大或易发生副反应等 (答案合理即可得分)
6 5 2CH2=CHCOOH+2Na → 2CH2=CHCOONa+H2↑ 乙醇、浓硫酸、乙酸 加热 振荡 原料损失较大或易发生副反应等 (答案合理即可得分)
【解析】试题分析: (1)苯与液溴发生取代反应生成溴苯和溴化氢;
(2)苯甲酸钠与NaOH反应生成苯和碳酸钠;
(3)碳架结构为![]() 的烷烃含有6种等效氢;在该 碳架上添加碳碳双键,根据不同的添加方式可以得出相应烯烃的数目。
的烷烃含有6种等效氢;在该 碳架上添加碳碳双键,根据不同的添加方式可以得出相应烯烃的数目。
(4)根据球棍模型图: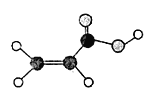 可知该有机物为丙烯酸,;
可知该有机物为丙烯酸,;
(5)①浓硫酸与乙醇、乙酸混合相当于浓硫酸稀释;加入催化剂、加热可以加快反应速率。
②乙酸乙酯不溶于水,将试管中收集到的产品倒入分液漏斗中,震荡、静置,然后分液。
③根据b装置可知,由于不是水浴加热,温度不易控制。
解析:(1)苯与液溴发生取代反应生成溴苯和溴化氢,反应方程式为![]() ;
;
(2)苯甲酸钠与NaOH反应生成苯和碳酸钠,方程式为![]() ;
;
(3)碳架结构为![]() 的烷烃含有6种等效氢,所以一溴代物有6种;在该 碳架上添加碳碳双键,有
的烷烃含有6种等效氢,所以一溴代物有6种;在该 碳架上添加碳碳双键,有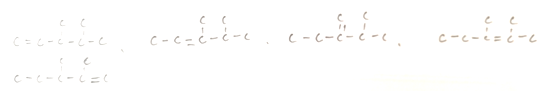
可以得出5种相应烯烃。
(4)根据球棍模型图: 可知该有机物为丙烯酸,与金属钠反应的化学方程式2CH2=CHCOOH+2Na → 2CH2=CHCOONa+H2↑;
可知该有机物为丙烯酸,与金属钠反应的化学方程式2CH2=CHCOOH+2Na → 2CH2=CHCOONa+H2↑;
(5)①浓硫酸与乙醇、乙酸混合相当于浓硫酸稀释,加入顺序是乙醇、浓硫酸、乙酸;加入催化剂、加热可以加快反应速率。
②乙酸乙酯不溶于水,将试管中收集到的产品倒入分液漏斗中,震荡、静置,然后分液。
③根据b装置可知,由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易发生副反应。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是:
A. 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去
B. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C. 已知2SO2(g)+ O2(g)![]() 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和KCl溶液中滴加AgNO3溶液,最先生成Ag2CrO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.6g CO和0.4g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 减少了6.0 g B. 增加了6.0 g C. 增加了5.2 g D. 减少了5.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是
A. 浓硫酸的质量增重 B. 澄清的石灰水变浑浊
C. 氢氧化钠的表面发生潮解 D. 钠的表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在原电池中,通常较活泼的金属做_____极,发生_______反应;
电解池中,与电源正极相连的极是_______极,发生________反应。
(2)下图所示水槽中试管内有一枚铁钉,放置数天后观察:
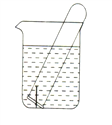
①若试管内液面上升,发生_____腐蚀,正极反应式为________________。
②若试管内液面下降,发生_______腐蚀,正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物的说法正确的是( )
A. 将水蒸气通过灼热的铁粉,粉末变为红棕色
B. Al2O3熔点高,可用作耐高温材料
C. 无水CuSO4 可用于干燥实验室制备的氢气
D. 制备Fe(OH)2时,为了隔绝空气可以向FeSO4溶液加少量的酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机化合物相关的说法正确的是( )
A. 淀粉、油脂、蛋白质都能水解,但水解产物不同
B. 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析
C. 1mol ![]() 与足量Na反应生成2molH2
与足量Na反应生成2molH2
D. 由乙烯推测丙烯的结构,丙烯分子中所有原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素是典型的非金属元素,其单质及其化合物具有广泛的用途。已知:KMnO4与浓盐酸常温下反应可生成氯气。根据所学化学知识及所给信息,回答下列有关问题:

(1)下列可以用来判断氯、溴、碘元素非金属性强弱的是 (填序号)。
①HCl、HBr、HI的热稳定性逐渐减弱;
②AgCl、AgBr、AgI的颜色逐渐加深;
③ HCl、HBr、HI的酸性依次减弱;
④ Cl2、Br2、I2的颜色逐渐加深;
⑤ Cl2、Br2、I2和H2反应条件由光照(或点燃)→ 一定温度→ 持续加热;条件由易到难;
⑥Cl2、Br2、I2的氧化性逐渐减弱。
(2)某化学探究小组选用右图所示的装置和下列所给的试剂来证明非金属性:Cl>I,请你按照他们的设计思路完成该实验。
可供选择的试剂有:①浓盐酸,②硝酸银溶液,③KMnO4,④稀盐酸,⑤淀粉碘化钾溶液, ⑥MnO2, ⑦NaOH溶液;⑧浓硫酸
烧瓶A中应盛放的药品是 (填序号),试管C中应盛放的药品是 (填序号),则装置D的作用是 。观察到 现象,即可证明非金属性Cl>I。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是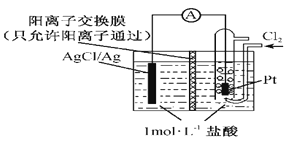
A. 正极反应为AgCl+e-=Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com